
|
Читайте также: |
| Red1 Red2 |
| Ox1 + n1 e Ox2 + n2e ■ |
| E E |
Способность одного вещества отдавать электроны другому веществу можно оценить также с помощью константы равновесия окислительно-восстановительной реакции. Эта константа связана с ЭДС реакции следующим образом. Пусть реакция между окислителем Ox1 и восстановителем Red2 состоит из двух полуреакций (полуреакцию с участием Red2 для удобства запишем как процесс восстановления окисленной его формы):
Ox1/Red1 ■ 0
Ox2/Red2
Наименьшее общее кратное для n1 и n2 обозначим как m. Суммарное уравнение реакции будет иметь следующий вид
a b
aRe d1 aox2
K
равн a b
aox1 aRe d2
| aOxi + bRed2 г aRedi + bOx2, |
| где a = m/nb b = m/n2. |
В состоянии равновесия AG = 0, AE = 0 и E Ox1 / Red1 = EOx2 / Re d2
| ox1 /Re d |
| lg- |
| E |
| + |
| 1/Red1 m / a |
| aRe d1 |
| a Re d 2 |
0,059, aox2
0,059, aoxx. + lg ^ = E 0
ox2 /Red2 m / b
| a ox2 aRe d 2 |
| aox1 aRe d1 |
| b • lg |
| - a • lg |
E0 E0 = 0,059
Ox1 / Re d1 Ox2 / Re d2 m
a b
ab
aox1 aRe d2
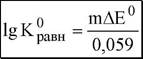
|
| m |
AT.0 0,059, aRed1 aox2 0,059, T^0 AE0 — lg = —lgK0
равн
m
Обратите внимание, что в выражение для расчёта константы равновесия окислительно-восстановительной реакции входит не произведение числа электронов n1 и n2, а их наименьшее общее кратное m, которое может быть равно этому произведению, а может быть и не равно.
Если lgK > 0, реакция может самопроизвольно протекать в прямом направлении. Чем больше величина K, тем больше "глубина" протекания окислительно-восстановительной реакции.
Пример 7.3. Рассчитать термодинамическую константу равновесия реакции
/3- + 2S2o32- г S4o|- + 3/ -
| +0,09В |
| если E |
+0,545В, E
IJ/3I ' S4O2" /2S2O2"
| равн |
о - (0,545-0,09^.2 = 15
0,059
Кравн - 1^1015
7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций
Дата добавления: 2015-09-07; просмотров: 262 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Уравнение Нернста | | | Комплексообразование |