
Читайте также:
|
Взаимодействие между молекулами реального газа обуславливает их взаимную потенциальную энергию  , которая переходит во внутреннюю энергию газа наряду с кинетической энергией движения молекул
, которая переходит во внутреннюю энергию газа наряду с кинетической энергией движения молекул 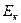 .
.
Найдем энергию ван-дер-ваальсовского газа.
Внутренняя энергия такого газа  , где
, где
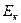 — суммарная кинетическая энергия молекул в Ц-системе (связанной с сосудом),
— суммарная кинетическая энергия молекул в Ц-системе (связанной с сосудом),
 — суммарная энергия взаимодействий молекул (собственная потенциальная энергия).
— суммарная энергия взаимодействий молекул (собственная потенциальная энергия).
Найдем  .: Работа сил притяжения равна убыли внутренней энергии
.: Работа сил притяжения равна убыли внутренней энергии  .
.
Силы притяжения характеризуются внутренним давлением  в уравнении Ван-дер-Ваальса.
в уравнении Ван-дер-Ваальса.
Тогда элементарная работа этих сил  , где знак минус обусловлен тем, что при расширении газа (
, где знак минус обусловлен тем, что при расширении газа ( >0) работа
>0) работа  должна быть отрицательной,
должна быть отрицательной,  < 0.
< 0.
Итак,  .
.
Мы представили  как убыль некоторой величины — она и является энергией
как убыль некоторой величины — она и является энергией  =
=  .
.
При  .
.
Суммарная же кинетическая энергия 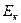 зависит от поступательного и внутреннего движений молекул, и определяется как
зависит от поступательного и внутреннего движений молекул, и определяется как  .
.
Таким образом, внутренняя энергия моля ван-дер-ваальсовского газа 
где  .
.
Если газ расширяется в пустоту без теплообмена с окружающими телами, то А = U, Q = 0, и согласно первому началу в этом процессе U= сопst. Значит, с ростом объема температура газа уменьшается (в отличие от идеального газа).
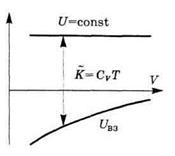 Это можно представить и наглядно (рис. 6.6).
Это можно представить и наглядно (рис. 6.6).
Видно, что при расширении газа (увеличении объема V) в случае U=const суммарная кинетическая энергия молекул газа, а значит и температура T, уменьшается. Газ охлаждается.
Теперь получим то же выражение для внутренней энергии, исходя из того, что внутренняя энергия является термодинамическим потенциалом 
Из уравнения состояния ван-дер-ваальсовского газа следует, что  .
.
Отсюда 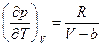 .
.
Подставив это выражение, получим  .
.
Произведя интегрирование по V, найдем, что  .
.
Вид функции f (Т) можно установить, воспользовавшись тем, при  выражение для внутренней энергии ван-дер-ваальсовского газа должно переходить в выражение для внутренней энергии идеального газа
выражение для внутренней энергии ван-дер-ваальсовского газа должно переходить в выражение для внутренней энергии идеального газа
U =  T.
T.
В итоге мы приходим к выражению  которое было получено, исходя из других соображений.
которое было получено, исходя из других соображений.
Получим для моля ван-дер-ваальсовского газа этого газа уравнение адиабаты в переменных T, V, если известна его молярная теплоемкость  .
.
Согласно первому началу термодинамики
 .
.
Отсюда 
Интегрируя это уравнение, получаем  ,
,
Или 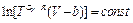 .
.
Таким образом, уравнение адиабаты имеет вид  .
.
Дата добавления: 2015-08-21; просмотров: 217 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Все реальные газы с уменьшением плотности приближаются по своим свойствам к идеальным газам, поэтому уравнение Ван-дер-Ваальса при переходит в уравнение Менделеева - Клапейрона. | | | Эффект Джоуля - Томсона |