
Читайте также:
|
Докажем, что поправка b в 4 раза больше собственного объема всех N А молекул одного моля газа:
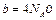 (6.9)
(6.9)
Для доказательства рассмотрим сферу радиуса d, центр которой совпадает с центром произвольной молекулы.
· Внутри этой сферы не могут находиться центры других молекул.
· Объем этой сферы является «запрещенным» объемом  для центров всех молекул, соударяющихся с данной.
для центров всех молекул, соударяющихся с данной.
· Поскольку молекулы сталкиваются попарно (вероятность столкновений трех и более молекул мала), приведенное рассуждение справедливо для любой пары молекул. Таким образом, в расчете на каждую из молекул газа недоступным будет объем, равный четырем объёмам одной молекулы, а для всех молекул – объем равный учетверенному суммарному объему молекул. Он в восемь раз больше собственного объема молекулы.
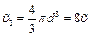
Поправка Ван-дер-Ваальса b представляет собой «запрещенный» объем, приходящийся на все NA молекул, т.е.
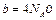 ,
,
что и требовалось доказать.
Из формулы (6.9)следует: значение b зависит от эффективного диаметра молекул, т. е. от химической природы газа.
2. Поправка 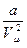 ,
,
- обусловлена силами притяжения между молекулами.
- имеет размерность давления,
- и ее часто называют внутренним давлением.
Несколько сложнее учесть влияние сил взаимного притяжения молекул, которые очень быстро убывают с увеличением расстояния между молекулами.
Поэтому можно считать, что каждая молекула взаимодействует лишь с теми молекулами, которые находятся от нее на расстояниях 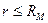 ,
,
где RM — радиус молекулярного действия, имеющий значение порядка 10 -9 м.
Сферу радиуса RM, построенную вокруг молекулы, называют сферой ее молекулярного действия.
· Если молекула находится вдали от стенок сосуда, то вся сфера ее молекулярного действия заполнена другими молекулами, так что результирующая сила притяжения для рассматриваемой молекулы равна нулю.
·  Если молекулы, находятся вблизи стенки MN сосуда (рис. 6.3).
Если молекулы, находятся вблизи стенки MN сосуда (рис. 6.3).
У них сферы молекулярного действия только частично находятся внутри газа (области, закрашенные на рис. 6.3).
Найдем равнодействующую сил притяжения, приложенных к произвольной молекуле К, находящейся в слое газа, пограничном со стенкой.
Для этого разобьем сферу молекулярного действия молекулы К на четыре области: а, б, г, д (рис. 6.4).
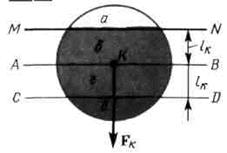 - Плоскости АВ и CD проведены параллельно поверхности стенки MN,
- Плоскости АВ и CD проведены параллельно поверхности стенки MN,
- плоскость CD симметрична поверхности стенки относительно диаметральной плоскости АВ.
Области б, г, д заполнены молекулами газа, область а - нет.
Силы, действующие на молекулу К со стороны молекул, находящихся в шаровых слоях
- б, г, взаимно уравновешиваются.
- Притяжение же молекулы К частицами, находящимися в шаровом сегменте д, ничем не компенсируется, так как в сегменте а молекул газа нет.
Очевидно, что результирующая сила Fk должна быть
· направлена перпендикулярно стенке внутрь газа (рис. 6.4).
· сила пропорциональна концентрации молекул газа: 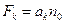 (6.10)
(6.10)
где коэффициент 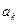 зависит
зависит
- от химической природы газа,
- расстояния 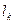 от центра молекулы К до стенки сосуда.
от центра молекулы К до стенки сосуда.
Если 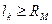 , то области а, д исчезают и Fk = 0.
, то области а, д исчезают и Fk = 0.
Таким образом, молекулы, отстоящие от стенок сосуда на расстояниях RM и больших, уже можно считать «внутренними».
Действие сил Fk приводит к тому, что в пограничном со стенкой слое газа молекулы
· движутся по направлению к стенке замедленно.
· ведут себя подобно шарам, которые прикреплены к пружинам и растягивают их в процессе движения за счет убыли своей кинетической энергии.
Поэтому удары молекул о стенки несколько смягчены.
Давление, производимое на стенки реальным газом, меньше, чем в случае идеального газа рид., имеющего ту же температуру Т и ту же концентрацию:
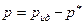 (6.11),
(6.11),
где р*— давление, обусловленное действием сил взаимного притяжения молекул (внутреннее давление).
Внутри газа силы взаимного притяжения молекул не влияют на их движение, и давление газа равно рид.
У стенок оно меньше этого давления и равно р.
Добавочное давление р* производит на газ слой его молекул, граничащих со стенками.
Оно вызвано силами Fk и равно
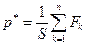 (6.12)
(6.12)
где сумма сил Fк распространена на все n молекул пограничного слоя газа,
S — площадь стенок сосуда.
Заменив Fk по формуле (6.10), получим
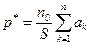 или
или 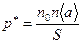 (6.13),
(6.13),
где 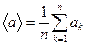 - среднее значение коэффициента
- среднее значение коэффициента 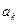 для всех молекул пограничного слоя, зависящее только от химической природы газа.
для всех молекул пограничного слоя, зависящее только от химической природы газа.
 - число молекул, заключенных в пограничном слое,
- число молекул, заключенных в пограничном слое,
Подставив это выражение в (6.13), получим
 (6.14),
(6.14),
Где
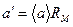 (6.15),
(6.15),
Из уравнений (6.14) и (6.15) имеем
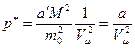 (6.16),
(6.16),
Коэффициент Ван-дер-Ваальса 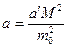 зависит только от химической природы газа
зависит только от химической природы газа
Из (6.16) и (6.11) получим выражение для давления внутри газа:

где р — давление газа на стенки сосуда.
Подставив в уравнение Клапейрона — Менделеева ( )вместо
)вместо  и рид вместо р, получим уравнение состояния реальных газов, которое было выведено нидерландским физиком Я. Д- Ван-Дер-Ваальсом (1873) и названо его именем:
и рид вместо р, получим уравнение состояния реальных газов, которое было выведено нидерландским физиком Я. Д- Ван-Дер-Ваальсом (1873) и названо его именем:
В результате уравнение состояния одного моля реального газа приняло вид
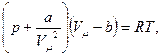 (1) - уравнение Ван-дер-Ваальса.
(1) - уравнение Ван-дер-Ваальса.
Здесь а и b — постоянные Ван-дер-Ваальса, для разных газов они имеют свои значения.
Если мы имеем дело не с одним, а с  молями газа объемом V, то в уравнении (1) следует сделать замену:
молями газа объемом V, то в уравнении (1) следует сделать замену:
 .
.
Газ, подчиняющийся уравнению (1), называют ван-дер-ваальсовским.
Уравнение Ван-дер-Ваальса при большой простоте дает возможность качественно объяснить широкий круг явлений в газах и в жидкостях.
Пример: Найдем давление, при котором плотность углекислого газа с температурой Т= 300 К равна  = 500 г/л.
= 500 г/л.
Считая газ ван-дер-ваальсовским, представим (1) в виде
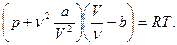 (2)
(2)
Подставив  и
и 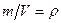 , получим:
, получим:
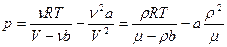 .
.
Для углекислого газа а = 0,367 Па·м /моль, b = 4,3·10 м /моль и  = 44 г/моль. В результате подстановки найдем р
= 44 г/моль. В результате подстановки найдем р  80 атм. Расчет же по формуле состояния идеального газа дает 280 атм. Различие весьма значительное.
80 атм. Расчет же по формуле состояния идеального газа дает 280 атм. Различие весьма значительное.
Дата добавления: 2015-08-21; просмотров: 110 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| При прочих равных условиях расстояние r1 тем меньше, чем выше температура газа | | | Все реальные газы с уменьшением плотности приближаются по своим свойствам к идеальным газам, поэтому уравнение Ван-дер-Ваальса при переходит в уравнение Менделеева - Клапейрона. |