
Читайте также:
|
зависимость Wn от r в области положительных значений Wn настолько «крутая», что даже значительные изменения температуры газа приводят к сравнительно небольшим изменениям величины r1. Поэтому в первом приближении можно считать, что r, зависит только от химической природы газа и представляет собой не что иное, как эффективный диаметр d молекул.
Из сказанного ясно, что возможность представления молекул газа в виде твердых шариков диаметра d связана с очень быстрым увеличением сил взаимного отталкивания молекул реального газа при уменьшении расстояния между ними.
Зависимость взаимной потенциальной энергии Wn двух молекул реального газа от расстояния г между ними неплохо описывается формулой Ленарда-Джонса (1924):
 (6.6)
(6.6)
где а1 и а2— постоянные положительные коэффициенты, зависящие от химической природы газа.
Дифференцируя выражение(6.6) по r, находим зависимость от r проекции Fr результирующей силы F взаимодействия двух молекул реального газа:
 , (6.7)
, (6.7)
где  и
и 
Анализ формулы:
Первый член в правой части формулы (6.7) соответствует силам межмолекулярного притяжения, которые часто называют ван-дер-ваальсовыми силами по имени нидерландского физика Я. Д. Ван-дер-Ваальса, который впервые начал учитывать межмолекулярное взаимодействие в газах.
Различают три типа сил межмолекулярного притяжения:
· Ориентационные - между полярными молекулами
· индукционные — между полярной и неполярной молекулами
· дисперсионные — между неполярными молекулами, а также между любыми другими парами молекул.
Все они имеют электрическую природу и зависят от расстояния r между молекулами по закону const/r7.,,
Второй член в правой части формулы (6.7) соответствует силам взаимного отталкивания молекул. Эти силы обратно пропорциональны r13, т. е. играют определяющую роль на малых расстояниях, соответствующих перекрытию электронных оболочек молекул. Существование сил взаимного отталкивания молекул при их очень сильном сближении удалось объяснить только в квантовой механике, основываясь на квантовом принципе запрета Паули.
6.2. Газ Ван-дер-Ваальса
Модели идеального газа, подчиняющегося уравнению Менделеева – Клапейрона  .
.
Однако с ростом давления при постоянной температуре оказывается, что  .
.
При р = 1000 атм. величина  становится вдвое больше, чем предписывает модель идеального газа (газ не «сжимается»).
становится вдвое больше, чем предписывает модель идеального газа (газ не «сжимается»).
Причин этому две:
1) собственный размер молекул; он и уменьшает объем, доступный для движения молекул, при нормальных условиях он составляет ~0,07 % объема сосуда с газом, а при 100 атм. уже ~70%;
2) сложный характер взаимодействия между молекулами.
Эти причины можно учесть путем введения поправок в уравнение состояния идеальных газов, что и сделал Ван-дер-Ваальс.
B первом приближении молекулы реального газа можно уподобить абсолютно твердым шарикам с диаметром d, между которыми действуют только силы взаимного притяжения. Учитывая конечные размеры молекул, мы приближенно принимаем во внимание действие сил взаимного отталкивания между ними. Такая модель газа, принятая Ван-дер-Ваальсом, позволила ему получить уравнение состояния реального газа более совершенное, чем уравнение Клапейрона — Менделеева.
1. Поправка b.
- связана с собственным объемом молекул,
- ее размерность м  /моль.
/моль.
Каждая молекула реального газа имеет объем  .
.
Поэтому молекулы газа движутся в сосуде менее свободно, чем «точечные» молекулы идеального газа.
Ван-дер-Ваальс учел собственный объем молекул газа путем замены в уравнении Клапейрона — Менделеева  полного объема
полного объема 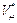 сосуда, занимаемого молем газа, на «свободный» объем:
сосуда, занимаемого молем газа, на «свободный» объем:
 , (6.8)
, (6.8)
где b — поправка Ван-дер-Ваальса, зависящая от собственного объема  молекулы – определяет ту часть объема, которая недоступна для движения молекул вследствие их конечных размеров.
молекулы – определяет ту часть объема, которая недоступна для движения молекул вследствие их конечных размеров.
Дата добавления: 2015-08-21; просмотров: 99 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Существенно, что | | | Эта константа равна учетверенному объему молекул. |