
Читайте также:
|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
СТЕРЛИТАМАКСКАЯ ГОСУДАРСТВЕННАЯ
ПЕДАГОГИЧЕСКАЯ АКАДЕМИЯ
З. М. КУРАМШИНА
БИОЛОГИЧЕСКАЯ ХИМИЯ
Учебное пособие
для студентов высших учебных заведений,
обучающихся по специальности
«032400 (050102) – Биология»
Печатается по решению Ученого
Совета Стерлитамакской
государственной педагогической
академии
Стерлитамак 2006
УДК 577 (075.8)
ББУ 28.072 я73
К 93
Рецензенты:
кандидат биологических наук А.П. Голощапов (медико-генетическая лаборатория, г. Стерлитамак); кафедра охраны окружающей среды и рационального природопользования (Стерлитамакский филиал Уфимского государственного нефтяного технического университета); доктор химических наук, профессор Стерлитамакской государственной педагогической академии В.И. Левашова; кафедра общей биологии (Стерлитамакская государственная педагогическая академия)
Ответственный редактор – кандидат биологических наук, доцент Д.Н.Карпов
(Стелитамакская государственная педагогическая
академия)
КУРАМШИНА З.М. БИОЛОГИЧЕСКАЯ ХИМИЯ: Учебное пособие для
К 93 студентов высших учебных заведений, обучающихся по специальности
«032400 (050102) – Биология». – Стерлитамак: Стерлитамак. гос. пед. академия, 2005. – 160 с.: 47 ил.
В пособии в сжатой форме представлены сведения об основных классах органических веществ, входящих в состав живых организмов. Рассмотрены вопросы, касающиеся обмена веществ и энергии, гормональной регуляции, взаимосвязи обмена веществ.
Предназначено для студентов биологических специальностей педагогических институтов и университетов, а также читателей, интересующихся процессами жизнедеятельности.
© З.М. Курамшина, 2005
© Стерлитамакская
государственная
педагогическая
академия, 2005
ПРЕДИСЛОВИЕ
Изучение биологической химии необходимо для понимания строения и функционирования живых организмов, познания разнообразия форм жизни и ее сущности. Исследование химических процессов, протекающих в живых организмах, важно не только для расширения знаний об организации живой материи, но и решения важнейших проблем в области биологии, медицины, экологии и других научных дисциплин и областях человеческой жизни.
Пособие составлено в соответствии с учебной программой, рекомендованной Учебно-методическим объединением учебных заведений РФ по педагогическому образованию по специальности «032400 (050102) – Биология». В пособии даны современные представления о структурной организации, биологической роли и функциях биологических макромолекул; представлены сведения о механизмах основных метаболитических процессов.
Вопросы, касающиеся характеристики основных классов органических веществ и процессов их обмена, выделены в отдельные главы. Обмен белков и нуклеиновых кислот рассмотрен с элементами молекулярной биологии, что имеет своей целью более полное освещение вопросов, связанных с переносом генетической информации, а также подготовку студентов к изучению новых курсов биотехнологии и молекулярной биологии. При написании пособия учитывались современные достижения биохимической науки.
В книге, кроме текстового материала, приведены схемы, таблицы, рисунки, формулы, уравнения реакций с целью наглядного представления структуры молекулы и биохимических циклов превращений веществ. Для закрепления материала и самостоятельной работы студентов в конце каждой главы приведены вопросы, задачи и список дополнительной литературы.
Учебное пособие, несомненно, будет полезно студентам-биологам, а также читателям, интересующимся основами биохимии. Может быть использовано для самостоятельной работы студентов.
ВВЕДЕНИЕ
Биохимия, или биологическая химия (от греч. bios – жизнь) – это наука, изучающая химический состав, строение и свойства веществ, входящих в состав живых организмов; превращения веществ и энергии. Биохимия – наука о химии жизни. Цель биохимии – познание молекулярных основ жизни. Биологическая химия старается выяснить, как биомолекулы взаимодействуют друг с другом и обеспечивают жизнедеятельность живого организма.
Биохимия условно подразделяется на статическую, динамическую и функциональную. Статическая биохимия изучает химическую природу организма; динамическая – обмен веществ; функциональная – процессы, лежащие в основе определенных проявлений жизнедеятельности.
В зависимости от объекта исследования биохимию классифицируют на биохимию человека и животных, биохимию растений, биохимию микроорганизмов и вирусов. Выделяют также биохимию медицинскую, ветеринарную, фармацевтическую, в каждой из которых есть свои направления.
Сфера биохимии очень широка, так как всюду, где существует жизнь, протекают различные химические процессы. Биохимия тесно связана с биологическими и другими науками. Например, знания биохимии нуклеиновых кислот важны для генетики, в свою очередь, в биохимии используются генетические подходы. В медицине для лечения различных заболеваний важно знать нарушения, в том числе и врожденные, метаболизма веществ. Биохимия тесно связана с разделами химии: органической, аналитической, физической, коллоидной.
Большое значение биохимия имеет для сельского хозяйства. На данных биохимии и физиологии базируется применение разнообразных химических препаратов в животноводстве и растениеводстве (витамины, кормовые добавки, антибиотики, эффективные и безопасные средства защиты растений).
Достижения биохимии широко используются во многих отраслях промышленности, например, в пищевой, хлебопечении, виноделии, сыроварении, консервировании продуктов. Ферментные препараты применяются в кожевенной, текстильной, мясной промышленности.
Современные методы исследований, такие как оптическая и флуоресцентная спектроскопия, электронная микроскопия, радиационные и иммунохимические тесты, ядерно-магнитная резонансная (ЯМР) спектроскопия, рентгеноструктурный анализ, электрофорез, хроматография, углубляют сведения о структуре биомолекул, процессах и химических реакций, протекающих в организме.
Из биохимии выделилась и сформировалась как самостоятельная наука – молекулярная биология. Развитие биохимии существенно расширило возможности прикладной инженерной биохимии – биотехнологии. В настоящее время разрабатываются и совершенствуются методы генетической и клеточной инженерии, совершенствуются процессы биотехнологических производств с целью получения новых пород животных и сортов растений с заданными свойствами; разрабатываются новые методы и средства диагностики, лечения и профилактики наследственных заболеваний и т.д.
Знание и изучение биологической химии необходимо для понимания молекулярной сущности жизни. Развитие биохимии важно для решения многих теоретических и практических задач.
Часть I.
ОСНОВНЫЕ КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ,
ВХОДЯЩИЕ В СОСТАВ ЖИВОЙ МАТЕРИИ
ГЛАВА 1. БЕЛКИ
Белки, протеины (от греч. «protos» – первый, важнейший) – высокомолекулярные органические соединения, построенные из остатков аминокислот. Этот класс веществ является важнейшим и играет первостепенную роль в жизнедеятельности всех организмов.
На долю белков приходится не менее 50% сухой массы органических соединений живой клетки. Белки обладают наибольшим по сравнению с другими веществами органической природы разнообразием структур и функций. Именно белки определяют, в конечном счете, фенотип любого организма, формируют облик всех живых систем.
Функции белков
Белки разнообразны по структуре и выполняют многочисленные биологические функции. Ни один класс биологически активных веществ не наделен такими свойствами, ни один биологический процесс не протекает без прямого или косвенного участия белков.
Белкам присуща каталитическая функция, так как к ним относятся ферменты, являющиеся высокоспецифическими катализаторами биохимических реакций.
Благодаря транспортной функции осуществляется перенос ионов, липидов, сахаров, аминокислот через биологические мембраны. Процесс осуществляется при участии транспортных белков или белков-переносчиков; кислород переносится с помощью гемоглобина и миоглобина.
Специфические защитные белки активизируются в ответ на поступление в организм чужеродных веществ (вирусов, бактерий и т.д.). Белки плазмы крови участвуют в свертывании крови и предохраняют организм от потери крови при ранениях.
Двигательные (сократительные) белки осуществляют работу мышц, расхождение хромосом при делении клеток, движение жгутиков.
Важную группу составляют регуляторные белки, контролирующие биосинтез белков и нуклеиновых кислот. Белковые гормоны участвуют в регуляции обмена веществ в организме.
Рецепторные белки, располагающиеся на плазматической мембране, принимают участие в восприятии информации о состоянии внешней среды и передают ее внутрь клетки при участии комплекса сигнальных систем.
Запасные белки растений и животных выполняют питательную (резервную) функцию. К ним относятся, например, белки яйца (овальбумин), молока (казеин) и другие.
Биологическая активность белков, разнообразие выполняемых ими функций обусловлены необыкновенной пластичностью и строгой упорядоченностью структуры белков.
Аминокислотный состав белков
В состав белков входит множество различных аминокислот, отличающихся строением радикала. Природа использует в белках двадцать a-аминокислот (табл.1). a-аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у a-углерода, замещен на аминогруппу (-NH2). Общая формула аминокислот: H2N – CH(R) – COOH, где R – боковая цепь (радикал).
Все разнообразие особенностей структуры и функций белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. В таблице 1 представлены формулы 20 аминокислот и трехбуквенные сокращенные обозначения, указаны также заменимые и незаменимые аминокислоты. Заменимые могут синтезироваться в организме, незаменимые не синтезируются и должны поступать с пищей.
Таблица 1
Классификация аминокислот
| № п/п | Название аминокислот | Сокращенное название | Формула | |
| I. Аминокислоты, содержащие неполярные (гидрофобные) радикалы | ||||
| 1. | Глицин | Гли | 
| |
| 2. | Аланин (незам. для детей) | Ала | 
| |
| 3. | Валин (незам.) | Вал | 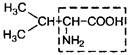
| |
| 4. | Лейцин (незам.) | Лей | 
| |
| 5. | Изолейцин (незам.) | Иле | 
| |
| 6. | Пролин | Про | 
| |
| II. Аминокислоты, содержащие полярные (гидрофильные) радикалы | ||||
| 7. | Серин | Сер | 
| |
| 8. | Треонин (незам.) | Тре | 
| |
| 9. | Цистеин | Цис | 
| |
| 10. | Метионин (незам.) | Мет | 
| |
| 11. | Аспарагин | Асн | 
| |
| 12. | Глутамин | Глн | 
|
Окончание таблицы 1
| № п/п | Название аминокислот | Сокращенное название | Формула | ||
| III. Аминокислоты, содержащие ароматические радикалы | |||||
| 13. | Фенилаланин (незам.) | Фен | 
| ||
| 14. | Тирозин | Тир | 
| ||
| 15. | Триптофан (незам.) | Трп | 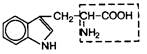
| ||
| IV. Аминокислоты, содержащие отрицательно заряженные радикалы | |||||
| 16. | Аспарагиновая кислота | Асп | 
| ||
| 17. | Глутаминовая кислота | Глу | 
| ||
| V. Аминокислоты, содержащие положительно заряженные радикалы | |||||
| 18. | Лизин (незам.) | Лиз | 
| ||
| 19. | Аргинин | Арг | 
| ||
| 20. | Гистидин (незам. для детей) | Гис | 
| ||
Классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой при физиологических значениях рН. Различают пять классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные; 5) положительно заряженные.
Для аминокислот характерна оптическая изомерия. Все природные аминокислоты обычно относятся к L-ряду (исключение составляет глицин, не имеющий хирального углеродного атома). D-формы аминокислот обнаруживаются в составе белков достаточно редко. Они выявлены в клеточной стенке некоторых бактерий, в составе некоторых антибиотиков.
В водных растворах аминокислоты находятся в виде амфотерных ионов. На ионизацию аминокислот в водных растворах большое влияние оказывает значение рН среды. В кислой среде аминокислоты заряжены положительным электрическим зарядом, в щелочной – отрицательным. Состояние аминокислоты, когда ее суммарный электрический заряд равен нулю, называется изоэлектрической точкой аминокислоты (ИЭТ). В ИЭТ амфотерные электролиты обладают минимумом растворимости, минимальной буферной емкостью.
Благодаря наличию карбоксильных и аминогрупп аминокислоты имеют свои специфические химические реакции, нашедшие применение при разделении, идентификации и количественном определении аминокислот.
Аминокислоты способны реагировать своими карбоксильными группами со спиратами, образуя сложные эфиры:

В специфических реакциях аминокислот особую роль играет реакционная способность a-аминогруппы. Аминокислоты могут реагировать с азотистой кислотой, образуя при этом гидроксикислоту и газообразный азот:

a-Аминогруппа аминокислот может вступать с формальдегидом:

Для обнаружения, идентификации и количественного анализа широкое применение нашла цветная реакция с нингидрином:

При рН 5,5 и нагревании с избытком нингидрина аминокислота дегидрируется, декарбоксилируется с образованием СО2, NH3 и альдегида, а нингидрин превращается в восстановленный нингидрин. Нингидрин, восстановленный нингидрин и аммиак затем конденсируются с образованием окрашенного соединения, причем образуется пигмент сине-фиолетового цвета, если аминокислота содержит свободную аминогруппу, и желтый пигмент, если a-аминогруппа замещена, как например, у пролина, гидроксипролина. Интенсивность окраски можно использовать для колориметрического определения концентрации аминокислот, например, в белковых гидролизатах после разделения аминокислот бумажной, ионообменной хромотографией или электрофорезом.
При слабощелочных значениях рН и комнатной температуре аминокислоты вступают в реакцию с 1-фтор-2,4-динитробензолом:
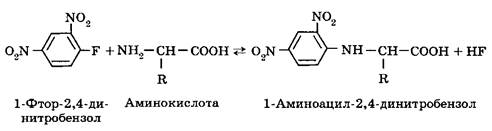
Аналогичная реакция с a-аминогруппой осуществляется с фенилизотиоцианатом:

Дата добавления: 2015-10-23; просмотров: 193 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Уроки биологии как основная форма обучения. | | | Структурная организация белков |