
|
Читайте также: |
Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температуры, присутствие активаторов или ингибиторов) на скорость ферментативной реакции.
Общие принципы кинетики химических реакций применимы и к ферментативным реакциям. Любая химическая реакция характеризуется константой термодинамического равновесия, достигаемой системой, и обозначается Кр. Так, например, для реакции:
А+В  С+Д, Кр=
С+Д, Кр=  .
.
Константы равновесия обычно находят из соотношения констант скоростей прямой и обратной реакций: Кр= к +1 / к –1.
В состоянии равновесия скорость прямой реакции равна скорости обратной реакции, а константа равновесия равна отшению констант скоростей прямой и обратной реакций. Величину, обратную константе равновесия, принято называть субстратной константой или, в случае ферментативной реакции, константой диссоциации фермент-субстратного комплекса, и обозначать символом Кs.
Так, в реакции E+ S  ES, Кs=
ES, Кs=  =
= 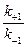 константа Кs зависит от химической природы субстрата и определяет степень их родства. Чем ниже значение Кs, тем выше сродство фермента к субстрату.
константа Кs зависит от химической природы субстрата и определяет степень их родства. Чем ниже значение Кs, тем выше сродство фермента к субстрату.
Для ферментативных реакций характерна особенность, связанная с явлением насыщения фермента субстратом. При низких концентрациях субстрата зависимость скорости реакции от концентрации субстрата является почти линейной и подчиняется кинетике первого порядка (скорость реакции S → P прямо пропорциональна концентрации субстрата). При высоких концентрациях субстрата скорость реакции максимальна, становится постоянной и не зависящей от концентрации субстрата. Реакция подчиняется кинетике нулевого порядка и целиком определяется концентрацией фермента. Возможны также реакции второго порядка, скорость которых пропорциональна произведению концентраций двух реагирующих веществ. В определенных условиях при нарушении пропорциональности говорят иногда о реакциях смешанного порядка.
Изучая явление насыщения, Л.Михаэлис и М.Ментен разработали общую теорию ферментативной кинетики. Они исходили из предположения, что ферментативный процесс протекает в виде следующей химической реакции:
E+ S  ES, E+S
ES, E+S  ES
ES
т.е. фермент E вступает во взаимодействие с субстратом S с образованием промежуточного комплекса ES, который далее распадается на свободный фермент и продукт реакции Р. Зависимость скорости реакции от концентрации субстрата описывается уравнением, названным в честь ученых уравнением Михаэлиса-Ментен:
 ,
,
где v– наблюдаемая скорость реакции при данной концентрации субстрата [S];
Ks – константа диссоциации фермент-субстратного комплекса, моль/л; Vmax – максимальная скорость реакции при полном насыщении фермента субстратом.
Уравнение Михаэлиса-Ментен в классическом виде не учитывало влияния на скорость ферментативного процесса продуктов реакции. Поэтому было предложено уравнение Бриггса-Холдейна:
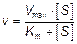 ,
,
где Кm представляет собой константу Михаэлиса.
Кm = Ks+ 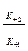
Для определения численного значения Кm обычно находят ту концентрацию субстрата, при которой скорость ферментативной реакции v составляет половину от максимальной Vmax, т.е. если v = ½ Vmax . Подставляя в уравнение Бриггса-Холдейна, получаем
 ,
,
разделив обе части уравнение на Vmax
 или Кm+[S]=2[S], откуда Кm= [S].
или Кm+[S]=2[S], откуда Кm= [S].
Таким образом, константа Михаэлиса численно равна конценрации субстрата (моль/л), при которой скорость данной ферментативной реакции составляет половину от максимальной.
Определение величины Кm имеет важное значение при выяснение механизма действия эффектов на активность ферментов и др.
Вопросы и задачи
1. Что такое ферменты?
2. Как образуется фермент-субстратный комплекс?
3. Сколько классов ферментов вам известно?
4. Какова роль окислительно-восстановительных ферментов и как они классифицируются?
5. Какой из коферментов принимает участие в превращении аминокислот?
6. Какова сущность ферментативного катализа?
Рекомендуемая литература
1. Грин Н., Статут У., Тейлор Д. Биология: В 3 т. – Т. 1. – Пер с англ. / Под ред. Р. Сопера. – М.: Мир, 1996. – 368 с.
2. Камилов Ф.Х., Давлетов Э.Г. Биохимия гормонов и механизм гормональной регуляции обмена веществ. – Уфа: Гилем, 1998. – 268 с.
3. Киршенблат Я.Д. Общая эндокринология: Учеб. пособие для ун-тов. – М.: Высшая школа, 1971. – 384 с.
4. Красильникова Л.А., Авксентьева О.А., Жмурков В.В., Садовниченко Ю.А. Биохимия растений / Под. ред. Л.А. Красильниковой. – Ростов н/Д.: Феникс; Харьков: Торсинг, 2004. – 224 с.
5. Плакунов В.К. Основы энзимологии. – М.: Логос, 2001. – 128 с.
6. Степанов В.М. Молекулярная биология. Структура и функции белков.– М.: Высшая школа, 1996. – 335 с.
7. Уилсон Дж., Хант Т. Молекулярная биология клетки: Сборник задач. – Пер. с англ. – М.: Мир, 1994. – 520 с.
8. Физиология и биохимия сельскохозяйственных растений / Н.Н. Третьяков, Е.И. Кошкин, Н.М. Макрушин и др.; Под ред. Н.Н. Третьякова. – М.: Колос, 2000. – 640 с.
Дата добавления: 2015-10-23; просмотров: 155 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Активный центр ферментов | | | Витамины группы А |