
|
Читайте также: |
2.1. Характерні реакції на іони Fe2+ і Fe3+
Дослід 1. Дія на солі заліза (ІІ) гексацианоферату (ІІІ) калію.
До розчину солі Мора у пробірці додати 1 краплю розчину гексацианоферату (ІІІ) калію (червоної кров’яної солі K3[Fe(CN)6]). Відмітити колір осаду, що утворився («турнбулева синь»), вказати хімічну назву. Дана реакція є характерною на іон Fe2+:
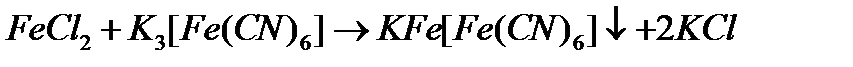
Написати рівняння реакції в іонному вигляді.
Дослід 2. Дія на солі заліза (ІІІ) гексацианоферату (ІІ) калію
Помістити у пробірку 2-3 краплі розчину хлориду заліза (ІІІ) і додати 1 краплю розчину гексацианоферату (ІІ) калію (жовтої кров’яної солі K4[Fe(CN)6]). Що спостерігається? Відмітити колір осаду, що утворився («берлінська лазур»), вказати хімічну назву.

У кристалічній структурі KFe[Fe(CN)6] обидва іони заліза (+2 та +3) знаходяться в октаедричному ціанідному оточенні і кожний ціанід-іон зв’язаний з обома іонами заліза одночасно. Тому, як показали дослідження, «турнбулева синь» та «берлінська лазур» повністю ідентичні KFe[Fe(CN)6].
Дослід 3. Дія тіоціанату (роданіду) на іони Fe2+ і Fe3+
В одну пробірку наливають 1-2 см3 розчину солі Мора, у другу – такий самий об’єм розчину FeCl3. У кожну пробірку додають по 2-3 см3 розчину KSCN. Звертають увагу на забарвлення розчинів, записують рівняння реакцій.
Іони Fe3+ утворюють з розчинами тіоціанату калію або амонію забарвлений у криваво-червоний колір розчин тіоціанату феруму (ІІІ) Fe(SCN)3:

У присутності надлишку тіоціанат-іонів утворюються іони [Fe(SCN)4]- чи [Fe(SCN)6]3-. Ця реакція дуже чутлива і тому забарвлення з’являється при дуже малій концентрації Fe3+.
2.2. Гідроксиди кобальту (ІІ) і нікелю (ІІ)
Дослід 1. Отримання гідроксиду кобальту (ІІ) і його окиснення
У дві пробірки помістити по 2-3 краплі розчину солі кобальту і додавати по краплям розчин лугу; спочатку з’явиться синій осад основної солі, котрий потім стає рожевим, що вказує на утворення гідроксиду кобальту (ІІ). Осад в одній пробірці ретельно перемішують скляною паличкою, а в другу додати 2-3 краплі 3 % - го розчину пероксиду водню. В якій з пробірок спостерігається окиснення гідроксиду кобальту? Написати рівняння реакцій.
Дослід 2. Отримання гідроксиду нікелю (ІІ) і його окиснення
У три пробірки помістити по 2-3 краплі розчину солі нікелю і додавати по краплям розчин лугу до випадіння осаду гідроксиду нікелю (ІІ). У першій пробірці осад ретельно розмішати скляною паличкою, у другу додати 2-3 краплі 3 % - го розчину пероксиду водню. Чи спостерігається зміна кольору осаду? Чи відбувається окиснення гідроксиду нікелю (ІІ) киснем повітря та пероксидом водню? У третю пробірку додати 1 краплю бромної води. Що спостерігається? Написати рівняння реакцій.
Дата добавления: 2015-10-26; просмотров: 94 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Загальна характеристика елементів VIII В групи | | | Отримання малорозчинних солей міді (ІІ). |