
Читайте также:
|
Конфигурация внешней электронной оболочки атома 3d64s2. Железо проявляет переменную валентность (наиболее устойчивы соединения 2- и 3-валентного Железа). С кислородом Железо образует оксид (II) FeO, оксид (III) Fe2O3 и оксид (II,III) Fe3O4(соединение FeO c Fe2O3, имеющее структуру шпинели).
Гидрооксид Fe(OH)2 образуется в виде белого осадка при действии едких щелочей или аммиака на водные растворы солей Fe2+ в атмосфере водорода или азота.
В чистом виде Железо из-за его низкой прочности практически не используется, хотя в быту "железными" часто называют стальные или чугунные изделия.
Схема строения атома: Fe +26)2)8)14)2Основные рудные минералы железа:
Гематит (железный блеск, красный железняк) – Fe2O3 (до 70% Fe);
Магнетит (магнитный железняк) – Fe3O4 (до 72,4% Fe);
Гетит – FeOOH
Гидрогетит – FeOOH*nH2O (лимонит) – (около 62% Fe);
Сидерит – Fe(CO3) (около 48,2% Fe);
Пирит – FeS2
2) реакция со щёлочью
Fe SO4 +2 NaOH = Fe(OH)2 ↓ + Na2 SO4
2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O- сульфат железа
Билет 27
1)По своей химической природе металлы – это химические элементы, атомы которых отдают электроны с внешнего или предвнешнего энергетического уровней, образуя при этом положительно заряженные ионы.
В Периодической системе химических элементов Д.И. Менделеева металлы располагаются ниже диагонали бериллий – астат. Элементы, расположенные вблизи диагонали, например, бериллий, алюминий, титан, германий, сурьма обладают двойственным характером и относятся к металлоидам. Металлы располагаются в начале периодов, к ним относятся s-элементы 1 и 2 групп, р-элементы 13 группы, все, кроме бора, 14 группы: германий, олово, свинец, 15 группы: сурьма, висмут, а также все d- и f- элементы.
По физическим свойствам все металлы-твердые вещества(кроме ртути)отличаются от неметалов особым видом связи(металическая)
Реакции металлов с кислотами
Металлы стоящие в электрохимическом ряду напряжений до Н восстанавливают кислоты-неокислители до водорода:
Mg+2HClà MgCl2+H2
2H2SO4 конц. + Cu = SO2↑ + CuSO4 + 2H2O
H2SO4 + Zn = Zn SO4 + H2 ↑
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
активные металлы будут реагировать с водой, металлы средней активности водой пассивируются, малоактивные не реагируют. магний реагирует только при нагревании: а менее активные металлы взаимодействуют только с парами воды. 
Почти все металлы непосредственно взаимодействуют с кислородом, образуя оксиды. Свойства оксидов определяются характером металлов. Оксиды наиболее активных металлов обладают основными свойствами. Имея свойства восстановителей, металлы реагируют с различными окислителями, прежде всего с неметаллами. С кислородом металлы реагируют при нормальных условиях или при нагревании с образованием окислов, например:
2Mg0 + O02 = 2Mg +2 O-2
В этой реакции атомы магния окисляются, атомы кислорода восстанавливаются. Благородные металлы, находящиеся в конце ряда, с кислородом реагируют. Активно происходят реакции с галогенами, например, сгорания меди в хлоре:
Cu0 + Cl02 = Cu +2 Cl-2
Все оксиды делят на три большие группы: основные, кислотные и амфотерные.
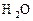 (окислитель (окислитель  ) + щелочь (например, ) + щелочь (например,  ) )
| ||
| Активные | Средней активности | Малоактивные |
Реагирует только

| Реагируют: 
| Не реагируют |
2) Жесткость воды – это ее свойство, зависящее от наличия в ней, главным образом, растворенных солей кальция и магния. Общая жесткость воды образуется из двух составляющих: карбонатной (временной),обусловленной концентрацией гидрокарбонатов (и карбонатов при рН 8,3) кальция и магния, и некарбонатной (постоянной), обусловленной концентрацией в воде кальциевых и магниевых солей сильных кислот. Временная жесткость характеризуется присутствием в воде наряду с катионами Ca2+, Mg2+ и Fe2+ гидрокарбонатных, или бикарбонатных анионов (HCO3-). При кипячении воды гидрокарбонаты разлагаются, образуя очень плохо растворимый карбонат кальция, углекислый газ и воду:
Ca2+ + 2HCO3- = CaCO3↓ + H2O + CO2↑
Единицы измерения гр/л
Методы устранения кипечение Са (НСО3)2=СаСО3+Н2O+CO2
Mg(HCO3)2=Mg(OH)2+2CO2
Осождают содой CaSO4+Na2CO3=CaCO3+Na2SO4
3) X=3^50/10
X =243
В 243 раза увеличится скорость реакции.
Билет 29.
Дата добавления: 2015-08-17; просмотров: 99 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Записать соответствующие химические реакции | | | Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Понятие об энергии активации. Влияние величины энергии активации на скорость реакции. |