
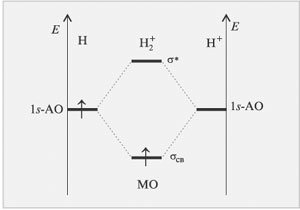
1) Применим метод молекулярных орбиталей и разберем строение молекулы водорода. Изобразим на двух параллельных диаграммах энергетические уровни атомных орбиталей исходных атомов водорода.

Метод молекулярных орбиталей позволяет наглядно объяснить образование ионов  и
и  , что вызывает трудности в методе валентных связей. На
, что вызывает трудности в методе валентных связей. На  -связывающую молекулярную орбиталь катиона
-связывающую молекулярную орбиталь катиона  переходит один электрон атома H с выигрышем энергии.
переходит один электрон атома H с выигрышем энергии.
2)Коррозия - это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой. Электрохимическая коррозия - наиболее распространенный вид коррозии металлов, это разрушение металла в среде электролита с возникновением внутри системы электрического тока.
Химическая коррозия - это вид коррозионного разрушения металла, связанный с взаимодействием металла и коррозионной среды, при котором одновременно окисляется металл и происходит восстановление коррозионной среды.
Оцинкованное железо получают, покрывая железо тонким слоем цинка. При таком контакте возникает гальванический элемент. Цинк имеет более отрицательный потенциал (-0,763 В), чем железо (-0,44 В) (табл. 7.1), поэтому он является анодом, а железо - катодом. а) Схема ГЭ записывается в кислой среде:
(-) Zn ½ HCl ½ Fe (+).
Анодный процесс: Zn - 2ē= Zn2+;
катодный процесс: 2H+ + 2ē = H2.
Следовательно, цинк в этом случае корродирует вместо железа. Подобная защита металла, при которой он играет роль катода в процессе электрохимической коррозии, называется катодной защитой, а цинк в этом случае является анодным покрытием.
б) Для коррозии на воздухе схема гальванического элемента: (-) Zn ½ H2O, O2 ½ Fe (+).
Анодный процесс: Zn - 2ē= Zn2+;
катодный процесс: 2H2O + O2 + 4ē = 4OH-.
Цинк защищает железо от коррозии даже после нарушения целостности покрытия.
Способы защита металла от коррозии: 1)удаление коррозионо-активных веществ из среды; 2)применение коррозионно-стойких сплавов; 3)замена металлов полимерами; 4)электро-химическая защита; 5)защитные покрытия.
3) 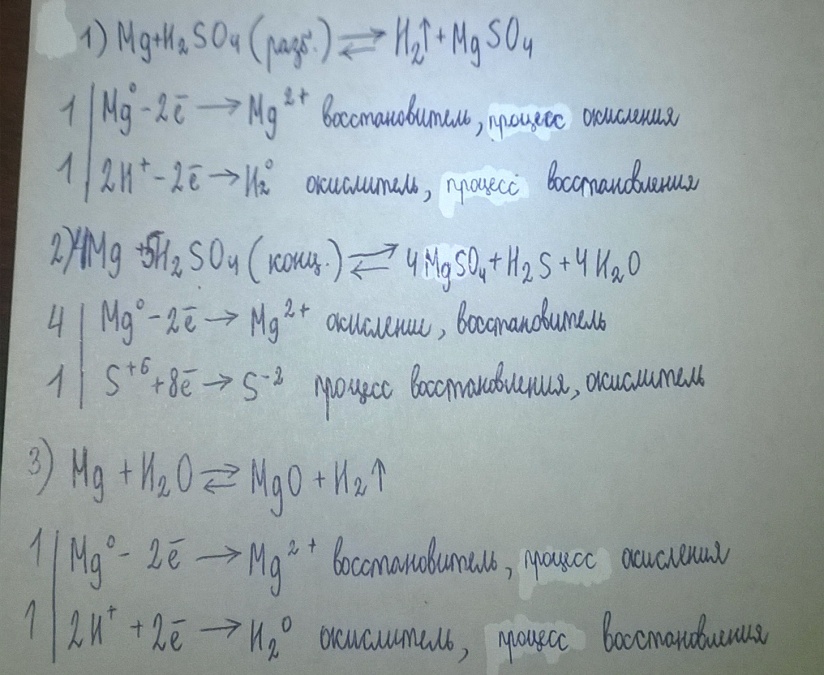
БИЛЕТ 23
Дата добавления: 2015-08-17; просмотров: 64 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Электролиз с растворимым анодом. Законы Фарадея выход по току, применение электролиза. | | | Номенклатура комплексных соединений |