
Читайте также:
|
NaCl + H2O  NaOH + HCl.
NaOH + HCl.
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов. уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:
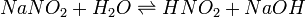

3) При увеличении давления равновесие сдвигается в сторону наименьшего объема. В первой реакции 2 моль аммиака занимают, меньший объем,и равновесие сместится вправо. Во второй реакции объемы субстратов и продукта равны и изменение давления на равновесии не скажется.
Билет 18
1)Типы ковалентных молекул: полярная, неполярная, примеры. Дипольный момент связи молекулы, чему он равен и в каких единицах измеряется? Поляризуемость ковалентной связи.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (H2, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
Дипольный момент электрический, векторная величина, характеризующая асимметрию распределения положительных и отрицательных зарядов в электрически нейтральной системе. Два одинаковых по величине заряда +q и —q образуют электрический диполь с дипольный момент m = q l, где l - расстояние между зарядами. Для системы из n зарядов qi радиусы-векторы которых ri,  В молекулах и молекулярных системах центры положительных зарядов q А совпадают с положениями атомных ядер (радиусы-векторы r A), а электронное распределение описывается плотностью вероятности r(r)
В молекулах и молекулярных системах центры положительных зарядов q А совпадают с положениями атомных ядер (радиусы-векторы r A), а электронное распределение описывается плотностью вероятности r(r)
В этом случае дипольный момент  Вектор дипольный момент направлен от центра тяжести отрицательных зарядов к центру тяжести положительных.
Вектор дипольный момент направлен от центра тяжести отрицательных зарядов к центру тяжести положительных.
В справочной литературе дипольный момент молекул приводят в дебаях (Д или D), по имени П. Дебая; 1 Д = 3,33564.10-30 Кл.м.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Дата добавления: 2015-08-17; просмотров: 72 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Реакции обмена | | | Понятия электродного потенциала, двойной электрический слой. Водородный электрод, стандартные электродные потенциалы, ряд напряжений металлов. Уравнение Нернста. |