
|
Читайте также: |
Найдём pH и степень диссоциации 0,01M раствора плавиковой кислоты HF. Её константа диссоциации равна

Обозначим степень диссоциации через α. Тогда [H+] = [F−] = Cα, [HF] = C(1-α). Подставив эти выражения в формулу для константы диссоциации, получим

Откуда следует квадратное уравнение относительно α:

Решая его по стандартной формуле, получим
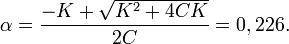
Применение приближённой формулы даёт ошибку около 15 %:

Исходя из найденного значения степени диссоциации, найдём pH раствора:

БИЛЕТ 15.
1.Межмолекулярная связь (силы Ван-дер-Ваальса). Это наиболее общий вид связи. Характеризуется как силой притяжения молекул в веществе между собой, так и силой их отталкивания. При этом образуются молярные структуры (мицеллы, фибриллы, глобулы, микрокристаллы) за счет притяжения между низкомолекулярными и особенно высокомолекулярными молекулами, что имеет большое значение для диэлектрических, механических и физических свойств (прочность, твердость, эластичность, прозрачность, влагопроницаемость). Энергия Ван-дер-Ваальсовыхвзаимодействий невысока: от 10 до 60 кДж/моль. Силы Ван-дер-Ваальса проявляются при взаимодействии молекул с насыщенными связями H2, O2,N2, CH4, Ar, Ne.
2. Вода - слабый электролит - диссоциирует, образуя ионы H+ и OH-. Эти ионы гидратированы, то есть, соединены с несколькими молекулами воды, но для простоты мы записывали их в негидратированной форме
H2O  H+ + OH-.
H+ + OH-.
Применяя к этому равновесию закон действия масс, имеем:
K =  = 1,8×10-16 (22°С)
= 1,8×10-16 (22°С)
Концентрацию молекул воды [H2O], то есть число моль в 1 л воды можно считать постоянной и равной [H2O] = 1000 г/л: 18 г/моль = 55,5 моль/л. Получаем
К´[H2O] = К(H2O) = [H+]×[OH-] = 10-14 (22°С)
Произведение концентраций [H+] и [OH-], то есть ионное произведение воды, есть величина постоянная и равная 10-14 при 22°С: [H+]×[OH-] = 10-14
Ионное произведение воды увеличивается с увеличением температуры
| t°С | |||||
| K(H2O) | 0,4×10-14 | 1,0×10-14 | 1,9×10-14 | 5,6×10-14 | 74×10-14 |
Соотношение между количеством ионов [H+] и [OH-] определяет характер среды:
[H+] =10-7= [OH-] - нейтральная среда
[H+] >10-7> [OH-] - кислая среда
[H+] <10-7< [OH-] - щелочная среда.
Водородный показатель рН - это отрицательный десятичный логарифм концентрации ионов водорода рН = - lg[H+].
Аналогично рOН = - lg[OH-].
Логарифмируя ионное произведение воды, получаем
pH + pOH = 14
рН раствора можно определить с помощью индикаторов (лакмуса, фенолфталеина., метилоранжа и др.), универсальной индикаторной бумаги или с помощью рН-метра.
Индикатор меняет свою окраску в зависимости от рН раствора в определенном интервале рН: метилоранж в области рН=3,1-4,4; лакмус при рН=5,0-8,0; фенолфталеин в пределах рН=8,0-10,0. Индикатор - это обычно малодиссоциированная кислота или основание, имеющие в нейтральных и ионных формах разные окраски. Так например, лакмус НА - красный, а его анион А- - синий:
НА  Н+ + А-
Н+ + А-
красный синий
цвет. 
3. При окислении 8,43 г металла образовалось
9,63 г оксида металла. Вычислите Мэк(Ме) и Мэк(МехОу).
Решение. Запишем схему процесса:
хМе +y/2 О2 → МехОу
и закон сохранения массы:
m(Ме) + m(О2) = m(МехОу),
откуда:
m(О2) = 9,63 – 8,43 = 1,20 г.
Иззаконаэквивалентов,
m(Ме)/М (Ме) = m(О2)/ М (О2)
учитывая, что Мэк(О2) = 8 г/моль-эк, находим:
М (Ме)= m(Ме) М (О2)/ m(О2)= 8,43 8/ 1,20=56,20 г /моль;
Mэк(МехОу) = Мэк(Ме) + Мэк(О2) = 56,2 + 8 = 64,2 г/моль-эк.
БИЛЕТ 16.
Дата добавления: 2015-08-17; просмотров: 126 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Диссоциация воды | | | Структура молекул |