
Читайте также:
|
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Электродный потенциал, разность электростатических потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение электродный потенциал обусловлено пространственным разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя.
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ, тонкий поверхностный слой из пространственно разделенных электрич. зарядов противоположного знака, образующийся на границе двух фаз. Поскольку пространств.разделение зарядов всегда сопровождается возникновением электрич. разности потенциалов, Д. э.с. можно рассматривать как своеобразный микроконденсатор, расстояние между обкладками которого определяется молекулярными размерами. Образование Д.э.с. оказывает существенное влияние на скорость электродных процессов, адсорбцию ионов и нейтральных молекул, устойчивость дисперсных систем, смачиваемость, коэф. трения и др. свойства межфазных границ.
Водор о дный электр о д, платиновая пластинка, электролитически покрытая платиновой чернью, погружённая в раствор кислоты с определённой концентрацией ионов водорода Н+ и омываемая током газообразного водорода. Потенциал водородного электрода возникает за счёт обратимо протекающей реакции
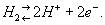
Между водородом, адсорбированным платиновой чернью, и ионами водорода в растворе устанавливается равновесие. Потенциал электрода Е определяется уравнением Нернста:
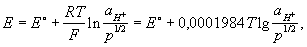
где Т — абсолютная температура (К), аН+ — активная концентрация ионов водорода (г-ион/л), р — давление водорода [кгс/см2 (атм)], Е° — нормальный (или стандартный) потенциал водородного электрода при р = 1 кгс/см2 (1 атм) и aH+ = 1. При любой заданной температуре Е° условно принято считать равным нулю. От потенциала стандартного водородного электрода отсчитывают потенциалы всех других электродов (так называемая водородная шкала потенциалов). При работе с водородным электродом необходима тщательная очистка водорода от примесей. Особенно опасны соединения серы и мышьяка, а также кислород, реагирующий с водородом на поверхности платины с образованием воды, что приводит к нарушению равновесия
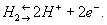
Водородный электрод применяют как электрод сравненияпри различных электрохимических измерениях и в гальванических элемента
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста
Нернст изучал поведение электролитов при пропускании электрического тока и открыл закон. Закон устанавливает зависимость между электродвижущей силой (разностью потенциалов) и ионной концентрацией. Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура. Таким образом, этот закон связывает термодинамику с электрохимической теорией в области решения проблем, касающихся сильно разбавленных растворов.  ,
,
где
·  — электродный потенциал,
— электродный потенциал,  — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
· 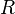 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
· 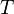 — абсолютная температура;
— абсолютная температура;
·  — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
· 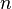 — число молей электронов, участвующих в процессе;
— число молей электронов, участвующих в процессе;
·  и
и  — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант 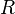 и
и  и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при  получим
получим

3) Мэ (Э (Al(OH)3))=(1/3)*78=26 г/моль
Mэ (H2CO3) = 62/2 = 31 г/моль
Мэ (N2O5) = 2,8 г/моль.
БИЛЕТ 19.
Билет
Вопрос
Ионная связь-Связь, возникшая между атомами с резко выраженными противоположными свойствами (типичным металлом и типичным неметаллом), между которыми возникают силы электростатического притяжения, называется электровалентной, или ионной связью.
Свойства:Так как ион может притягивать к себе ионы противоположного знака в любом направлении, ионная связь в отличие от ковалентной отличается ненаправленностью.
Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. Поэтому они могут притягивать и другие ионы противоположного знака, то есть ионная связь отличается ненасыщенностью.
1) ненасыщаемость (каждый ион, взаимодействуя с противоположным во всех направлениях, не компенсирует силовые поля)
2) ненаправленность (любой ион в любом направлении способен притягивать к себе ион противоположного заряда)
Свойства веществ с ионной связью: твердые, тугоплавкие, не имеют запаха, часто хорошо растворимые в воде
Вопрос
Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани. Переход химической энергии в электрическую энергию происходит в гальванических элементах.
Элемент Вольта состоял из серебряных и цинковых пластинок, нанизанных на непроводящий стержень; между пластинками были прокладки,смоченные слабой серной кислотой. Первую и последнюю пластину соединяли с проводами. Каждая пара пластинок давала 1,1В
ДАНИЕЛЯ-ЯКОБИ ЭЛЕМЕНТ, медно-цинковый гальванический элемент. Состоит из Си и Zn электродов, которые погружены в растворы CuSO4 и ZnSO4, разделенные пористой перегородкой:  Источником электрич. энергии служит своб. энергия хим. р-ции Zn + + CuSO4->ZnSO4 + Си. Эдс элемента складывается из разницы потенциалов электродов, а также диффузионного потенциала на границе
Источником электрич. энергии служит своб. энергия хим. р-ции Zn + + CuSO4->ZnSO4 + Си. Эдс элемента складывается из разницы потенциалов электродов, а также диффузионного потенциала на границе 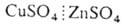 ; при 25 °С и равенстве концентраций р-ров составляет ~ 1,10 В. Элемент разработан в 1836-40 Дж. Даниелем и независимо от него Б. С. Якоби; в наст, время используется в осн. в лаб. исследованиях. О.Л.Петрий.
; при 25 °С и равенстве концентраций р-ров составляет ~ 1,10 В. Элемент разработан в 1836-40 Дж. Даниелем и независимо от него Б. С. Якоби; в наст, время используется в осн. в лаб. исследованиях. О.Л.Петрий.
Электродвижущая сила (ЭДС) гальванического элемента зависит от материала электродов и состава электролита. ЭДС описывается термодинамическими функциями, протекающих электрохимических процессов, в виде уравнения Нернста.
:  не кипишуй,читай ниже,там ясно станетJ
не кипишуй,читай ниже,там ясно станетJ
гдеE0-стандартный потенциал редокс-системы;
R-универсальная газовая постоянная,равная 8,312 Дж/(моль К);
T-абсолютная температура,К;
F-постоянная Фарадея,равная 96485 Кл/моль;
n-число электронов, принимающих участие в электродной реакции;
aox, ared - активности соответственно окисленной и восстановленной форм редокс-системы;
[ox], [red]-ихмолярные концентрации;
Гox, Гred - коэффициенты активности.
Поляризационные явления в гальваническом элементе.
Поляризация электродов (анода и катода) это смещение электродных потенциалов от их теоретических значений при прохождении тока в цепи, то есть при работе гальванического элемента она возникает в результате отставания процессов окисления на аноде и восстановления на катоде от процессов перехода электронов во внешнее цепи.
Вопрос
Хлор -1 NaCl, + 7 NaClO4 хлор 1s 22s 22p 63s 23p5
Сера: -2 (H2S), +6 (SO3, H2SO4). Сера 1s 22s 22p 63s 23p4
Азот: -3 (NH3), +5 (N2O5, HNO3). Азот 1s 22s 22p 3
углерод -4(СН4) и +4 (СО2) углерод 1s 22s 22p 2
Билет 20
Дата добавления: 2015-08-17; просмотров: 312 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Соль образована сильным основанием и сильной кислотой. | | | Произведение растворимости трудно растворимого сильного электролита, пример. Условия выпадения и растворения осадка. |