
Читайте также:
|
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале обычно от 0 °C до 100 °C. Правило:При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
Уравнение, которое описывает это правило, следующее:
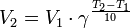
где 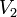 — скорость реакции при температуре
— скорость реакции при температуре 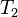 ,
, 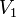 — скорость реакции при температуре
— скорость реакции при температуре 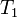 ,
, 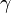 — температурный коэффициент реакции.
— температурный коэффициент реакции.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
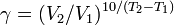
Уравне́ние Арре́ниуса- устанавливает зависимость константы скорости 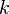 химической реакции от температуры
химической реакции от температуры 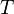 .
.
Согласно простой модели столкновений, химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации 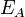 ), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией
), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией 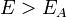 , пропорционально
, пропорционально 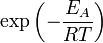 . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
. В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
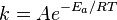
Здесь 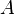 характеризует частоту столкновений реагирующих молекул,
характеризует частоту столкновений реагирующих молекул, 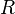 — универсальная газовая постоянная. В рамках теории активных соударений
— универсальная газовая постоянная. В рамках теории активных соударений 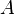 зависит от температуры:
зависит от температуры:
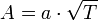
Скорость химической реакции зависит от энергии ее активации. Эта энергия необходима для эффективного соударения молекул, приводящего к их взаимодействию. Энергия активации (Еа) - энергия, необходимая для достижения системой переходного состояния, называемого активированным (или переходным) комплексом, который превращается в продукты реакции уже самопроизвольно.Энергия активации Еа равна разности энергий переходного и исходного состояний:
Еа = Еперех.сост. - Еисх.сост.
Билет 28.
Гомогенные и гетерогенные системы, примеры. Скорость гомогенных реакций. Закон действующих масс. Константа скорости реакции, её физический смысл.
Гомоге́нная систе́ма - однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков. В гомогенной системе из двух и более химических компонентов, каждый элемент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
Примеры: жидкие или твердые растворы, лед, смесь газов.
Гетероге́нная систе́ма — неоднородная система, состоящая из однородных частей, разделённых поверхностью раздела. Однородные частей могут отличаться друг от друга по составу и свойствам. Примерами гетерогенных систем могут служить: жидкость — насыщенный пар; насыщенный раствор с осадком; многие сплавы. Твёрдый катализатор в токе газа или жидкости тоже гетерогенная система.
Чем больше концентрация молекул (А) или (Б) в смеси, тем больше вероятность столкновения между ними. Если обозначить буквами А и Б (в квадратных скобках) молярные концентрации этих веществ, то скорость реакции будет пропорциональна произведению этих молярных концентраций:
v = k[А][Б] (2)
Константу скорости k можно определить экспериментально: она численно равна скорости реакции в тот момент, когда концентрации исходных веществ равны 1 моль/л:
v = k[А][Б] = k[1][1], следовательно, в этот момент v = k.
Закон действующих масс - скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Для одностадийной гомогенной реакции типа А+В продукты реакции этот закон выражается уравнением:
где v - скорость реакции; c A и c B - концентрации веществ А и В, моль/л;
k - коэффициент пропорциональности, называемый константой скорости реакции.
v = k c A c B,
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
БИЛЕТ 30.
1) Аморфное состояние полимера. 3 физических состояния аморфных полимеровю
Эксплуатационные свойства пластиков и эластомеров на основании термомеханических
кривых.
состояние аморфного полимера сравнивают обычно с состоянием переохлажденной жидкости, высокая вязкость которой исключает ее свободное течение и обеспечивает устойчивость формы, что свойственно как твердому телу. Стеклообразное состояние у низкомолекулярных веществ означает потерю подвижности всех молекул. Стеклообразное состояние у полимеров наблюдается тогда, когда их макромолекулы лишены подвижности. Этого можно достичь понижением температуры. Поскольку макромолекулы совершают движение не как единое целое, а сегментами (т.е. частями, и это отдаленно напоминает движение гусеницы), то для фиксации всей цени достаточно зафиксировать лишь часть сегментов, при этом другая часть на них может сохранять некоторую свободу перемещения. Это обстоятельство является одной из причин больших деформаций полимерных стекол, к которым приложены значительные усилия. При стекловании между макромолекулами не возникает новых типов связей, В затвердевшем полимере наблюдается ближний порядок, а расположении отдельных частей и атомных групп макромолекул.
Аморфное состояние полимера характеризуется отсутствием упорядоченности в расположении макромолекул.
Для аморфных полимеров в зависимости от температуры (и величины механического напряжения) возможны три физических (деформационных) состояния: стеклообразное, высокоэластическое и вязкотекучее
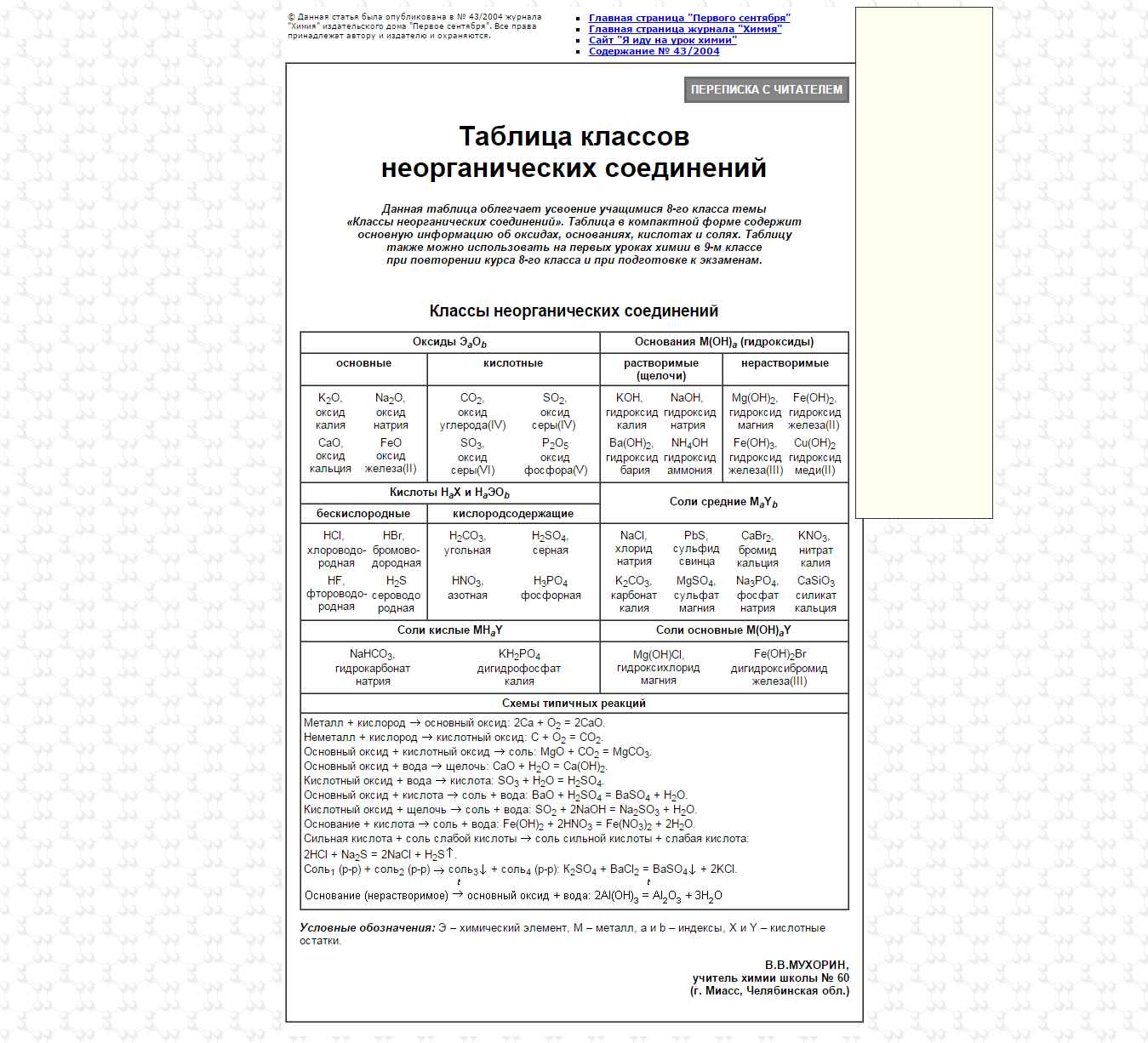
2) Основные классы неорганических соединений
Кислотный оксид + вода = кислота (исключение - SiO2)
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4
Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O
Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH
Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O
Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O (Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4])
Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3
Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2O
Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3)
Дата добавления: 2015-08-17; просмотров: 287 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Чистое Железо получают в относительно небольших количествах электролизом водных растворов его солей или восстановлением водородом его окислов. | | | Аннотация |