
Читайте также:
|
Тепловые эффекты химических реакций сильно зависят от температуры при которой осуществляется данная реакция.
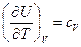 (1)
(1)
 (2)
(2)
Для выявления этой зависимости при р=const и V=const воспользуемся данными уравнениями. Пусть процесс осуществляется при р=const. Запишем уравнение (1) для исходного и конечного состояний системы.
 (3)
(3)
 (4)
(4)
где Н1 и Н2 – значения энтальпии для исходного и конечного состояний системы
ср/ и ср// - величины теплоемкости для исходного и конечного состояний системы
Для химической реакции 
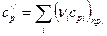
νi – стехиометрические коэффициенты
Вычтем почленно (1) из (2):
 - уравнение Кирхгоффа
- уравнение Кирхгоффа
Рассуждая аналогично для процесса при V=const с использованием (1) получим:
 - уравнение Кирхгоффа
- уравнение Кирхгоффа
Закон Кирхгоффа: Температурный коэффициент теплового эффекта химической реакции ( ) равен сумме теплоемкостей продуктов ее за вычетом суммы теплоемкостей исходных веществ с учетом стехиометрических коэффициентов.
) равен сумме теплоемкостей продуктов ее за вычетом суммы теплоемкостей исходных веществ с учетом стехиометрических коэффициентов.
Разделим переменные в уравнении Кирхгоффа:

Проинтегрируем данное уравнение в неопределенных пределах:


где ΔН – тепловой эффект реакции при температуре Т.
Теперь проинтегрируем уравнение Кирхгоффа в форме (3) в определенных пределах, приняв за нижний предел стандартную температуру (298К):
 - рабочее уравнение.
- рабочее уравнение.
Теплоемкости веществ часто выражаются эмпирическими коэффициентами:
cp=a+bT+cT2+c//T2
(значения а, b, c, c/ табл.)
Δcp=Δa+ΔbT+ΔcT2+Δc//T2
Пример: N2+3H2=2NH3
Δa=2aNH3-aN2-3aH2
Δb=2bNH3-bN2-3bH2
Δc=…
Подставим теперь Δcp в уравнение (1) и проведем интегрирование:

Иногда в интервале температур от 298 до Т вещества меняют свое агрегатное состояние, а с изменением агрегатного состояния меняется Δср=f(T). Во избежание ошибок в данном случае весь интервал интегрирования разбивается на два и более интервалов. Рассмотрим простейший случай, когда только одно вещество меняет свое агрегатное состояние, тогда

где ф.п. – фазовое превращение (фазовый переход).
Дата добавления: 2015-08-10; просмотров: 93 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| К некоторым термодинамическим процессам | | | Теплоемкость идеального газа |