
Читайте также:
|
Интенсивные свойства не зависят от массы системы (температура, давление, молярная теплоемкость, молярный объем и т.д.).
I закон термодинамики
В основу термодинамики положены законы или начала термодинамики. Выделяют три закона т/д. Законы т/д не являются теоретическими положениями, а имеют эмпирический характер (опытный). В основу законов т/д положен многовековой опыт человечества. С помощью законов т/д характеризуется состояние т/д систем, а также процессов протекающих в этих системах. Все процессы подразделяются на обратимые и необратимые.
Обратимым процессом называется процесс, при осуществлении которого в обратном направлении повторяются все промежуточные стадии (без изменений в окружающей среде).
Необратимый - процесс, при осуществлении которого в обратном направлении не повторяется по крайней мере одна из его стадий. В реальных условиях природы и техники все процессы необратимы, но некоторые из них могут как угодно близко подходить к обратимому процессу. Наилучшей моделью обратимого процесса может служить бесконечно медленно протекающий равновесный процесс (один и тот же процесс может протекать обратимо и необратимо).
Пример: процесс расширения газа под днищем поршня
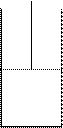 |
р
р’
р – внешнее давление
р’ – давление под днищем поршня
р’ > р
Если убрать нагрузку на поршень, то произойдет расширение газа и будет совершена работа расширения.
Если нагрузку на поршень убрать мгновенно, то произойдет быстрое необратимое расширение газа и при этом будет совершена работа
Aнеобр.=рΔV, где ΔV – разность объемов газа в конечном и исходном состояниях.
Осуществим теперь обратимое расширение газа под поршнем для чего будем уменьшать нагрузку на поршень бесконечно медленно (чтобы в любой момент времени система находилась в состоянии равновесия)
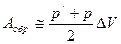 Аобр. > Анеобр .
Аобр. > Анеобр .
В термодинамике принято характеризовать состояние систем термодинамическими функциями состояния, а процессы, протекающие в этих системах – изменениями термодинамических функций состояния. Любая т/д функция состояния обладает двумя свойствами:
1. Свойство аддитивности. Оно заключается в том, что значение т/д функции состояния для всей системы складывается из величин этой функции для отдельных частей системы
2. Изменение любой т/д функции состояния не зависит от пути протекания процесса, а определяется только начальным и конечным состояниями системы.
Появление первого закона т/д связано с созданием тепловых двигателей. С появлением таких двигателей перед человеком встала задача создания таких тепловых машин, которые производили бы как можно больше работы при минимальных затратах тепла, а идеалом являлся такой тепловой двигатель, который производил бы работу вообще без затраты энергии. Такой двигатель получил название вечного двигателя I-го рода.
Поэтому главной формулировкой I-го закона т/д является запрет вечного двигателя I-го рода. Первый закон т/д – это закон об эквивалентности теплоты и работы.
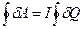
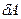 - приращение работы
- приращение работы
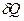 - приращение теплоты
- приращение теплоты
Значение механического эквивалента теплоты было экспериментально определено Майером и Джоулем. Если процесс не круговой, то 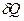 ≠
≠ 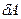
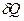 -
- 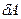 =dU
=dU
dU – приращение внутренней энергии
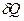 =dU+
=dU+ 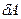 - математическое выражение I-го закона термодинамики (в дифференциальной форме).
- математическое выражение I-го закона термодинамики (в дифференциальной форме).
Тепло, сообщенное системе (такое тепло в т/д считается положительным) расходуется на увеличение внутренней энергии ее и совершение работы.
Q=ΔU+A - математическое выражение I-го закона термодинамики (в интегральной форме).
Первый закон т/д является прямым следствием из более общего закона – закона сохранения энергии. Он универсален и в равной мере применим к любым процессам (обратимым и необратимым).
Иногда работу процесса подразделяют на две составляющие – работу расширения и другие виды работы.
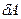 = рΔV+
= рΔV+ 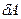 ’
’
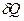 =dU+ рΔV+
=dU+ рΔV+ 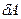 ’
’
В природе и технике очень часто единственной работой, совершаемой системой является работа расширения (А’=0).
Для этого случая 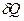 =dU+ рΔV
=dU+ рΔV
Дата добавления: 2015-08-10; просмотров: 94 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Основные определения и понятия термодинамики | | | Как термодинамическая функция состояния |