
Читайте также:
|
На данный момент отсутствуют общие методы расчета теплоемкости жидких веществ. Для выражения температурной зависимости жидкостей используется уравнение
cp=a+bT+cT2+c//T2
(значения а, b, c, c/ табл.)
Истинная теплоемкость – теплоемкость для данной температуры.
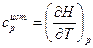
Если разделить переменные, то получим
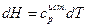
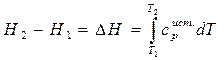
Разделим левую и правую части уравнения на (Т2-Т1), получим
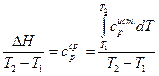
где 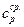 - средняя теплоемкость.
- средняя теплоемкость.
Средняя теплоемкость – количество тепла необходимое для нагревания вещества от Т1 до Т2.
II-ой закон термодинамики
Он запрещает создание двигателей, которые осуществляли бы работу за счет тепловой энергии окружающих предметов без разности температур, то есть он запрещает создание вечных двигателей II-го рода. Существует несколько формулировок (постулатов) II-го закона т/д.
I постулат Оствальда: Невозможно построить вечный двигатель II-го рода.
II постулат Клаузиуса: Никакая совокупность процесса не может приводить к самопроизвольному переходу тепла от холодного тела к горячему, тогда как самопроизвольный переход тепла от горячего тела к холодному может быть единственным результатом процесса.
III постулат Томпсона: Никакая совокупность процесса не может приводить к полному превращению теплоты в работу, тогда как превращение работы в теплоту может быть единственным результатом процесса.
II закон термодинамики решает вопрос о направлении протекания самопроизвольных процессов в термодинамических системах, поэтому этот закон имеет различное математическое выражение для обратимых и необратимых процессов.
Математическое выражение II-го закона термодинамики
для обратимых процессов
Предположим, что протекает какой-либо обратимый процесс в идеальном газе.
Принцип Каратеодори: В непосредственной близости от любого т/д состояния системы существуют такие состояния, которые недостижимы адиабатным путем (без теплообмена с окружающей средой).
Рассмотрим систему – идеальный газ.
 p
p
ΔU 2
1 -ΔU
T
1 – исходное состояние
Сообщим системе количество тепла Q. В результате этого система перейдет в состояние 2. В соответствии с принципом Каратеодори невозможно вернуться в состояние 1 из 2 адиабатным путем (без теплообмена с окружающей средой). Этот принцип является прямым следствием из II-го закона термодинамики. Для доказательства воспользуемся принципом от противного. Предположим, что из 2 в 1 можно вернуться адиабатным путем. Запишем уравнение I-го закона т/д последовательно для прямой и и обратной стадий циклического процесса.
Для прямой стадии Q=ΔU+A1 (1)
Для обратной стадии 0=-ΔU+A2 (2)
где А2 – работа предполагаемого адиабатного процесса.
Сложим почленно (1) и (2):
Q=A1+A2
Получили, что при осуществлении циклического процесса вся теплота, сообщенная системе, превращена в работу, но это не возможно, так как противоречит II-му закону т/д в формулировке Томпсона. Следовательно, наше предположение не верно и принцип Каратеодори справедлив. Из принципа Каратеодори вытекает как следствие, что теплота не является функцией состояния системы, но существует какая-то функция состояния связанная с теплотой (S=f(T)).
Убедимся в этом на примере обратимого процесса, протекающего в идеальном газе. Запишем математическое выражение I-го закона термодинамики для данного процесса в следующей форме:
δQ=cVdT+pdV (1)
Тогда учитывая, что для 1 моль идеального газа  получим
получим
δQ=cVdT+RTdlnV (2)
Q=f(T,lnV)
Из математики если z=f(x,y) и δz=Mdx+Ndy,
то 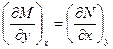
При 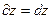 , т.е. z- полный дифференциал
, т.е. z- полный дифференциал
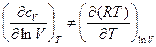
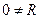
Данное равенство не соблюдается, следовательно, δQ не является полным дифференциалом, а теплота не является функцией состояния системы. Поделим левую и правую части уравнения (2) на Т:
Тогда 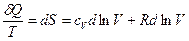 (3)
(3)
dS обладает свойствами полного дифференциала, поскольку перекрестные производные одинаковы:
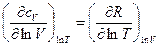
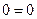
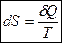 (4)
(4)
Функция S обладает всеми свойствами функции состояния – это энтропия.
Поэтому важнейшим выводом из II-го закона т/д является вывод о существовании энтропии как термодинамической функции состояния, а уравнение (4) представляет собой математическое выражение II-го закона т/д для обратимых процессов в идеальном газе.
Докажем теперь, что уравнение (4) справедливо для любых обратимых процессов, протекающих в любых т/д системах. Рассмотрим для этого систему, состоящую из 2-х частей:
 |
1 2
Пусть 1 представляет идеальный газ, а вторая часть произвольное вещество. Пусть система находится в состоянии термодинамического равновесия (Т=const). Пусть без нарушения равновесия бесконечно-малое количество δQ1 теплоты переходит от части 1 к 2. Тогда вторая часть системы получит точно такое же количество тепла δQ2.
δQ1=-δQ2
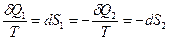
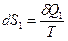 ,
, 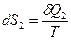
Уравнение (4) справедливо для любых т/д процессов в любых т/д системах.
Математическое выражение II-го закона термодинамики
для необратимых процессов
Предположим, что между одними и теми же исходными и конечными состояниями системы осуществляется какой-либо т/д процесс сначала обратимо, а затем необратимо. Запишем уравнение I-го закона т/д для обратимого и необратимого процессов.
δQобр.=dU+δAобр. (1)
δQнеобр.=dU+δAнеобр. (2)
Вычтем почленно (2) из (1):
δQобр.- δQнеобр.= δAобр.- δAнеобр. (3)
Проанализируем полученное выражение:
Разности в левой и правой частях уравнения (3) могут быть =0, >0 и <0.
1) рассмотрим первый случай, когда =0:
δQобр.- δQнеобр.=0, δAобр.- δAнеобр. =0
Но эти равенства невозможны, так как теплота и работа не являются функциями состояния системы.
Следовательно, δQобр.- δQнеобр.≠0, δAобр.- δAнеобр. ≠0
2) второй случай
δQобр.- δQнеобр.>0, δAобр.- δAнеобр. >0
В термодинамике положительной считается теплота, переходящая от окружающей среды к системе. Следовательно, выражение (3) будет иметь следующий физический смысл:
Вся теплота, сообщенная системе превращена в работу, но это невозможно, так как противоречит II-му закону т/д в формулировке Томпсона. Предположение неверно.
3) третий случай
δQобр.- δQнеобр.<0, δAобр.- δAнеобр. <0
Выражение (3) имеет физический смысл:
Вся работа, совершенная системой, превращена в теплоту, но но это вполне возможно, так как не противоречит II-му закону т/д в формулировке Томпсона.
Следовательно, δQобр.>δQнеобр.
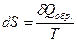 >
> 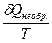
dS> 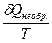 (4)
(4)
Неравенство (4) – это математическое выражение II-го закона т/д для необратимых процессов.
δAобр.> δAнеобр. Aобр.>Aнеобр.
Аобр.=Аmax
Поэтому работу обратимого процесса будем называть максимальной работой процесса. Очень часто математическое выражение II-го закона термодинамики для обратимого и необратимого процессов объединяют в одно выражение, имея в виду, что знак > - для необратимого процесса, а знак = - для обратимого.
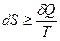 (5)
(5)
Применение II-го закона термодинамики
к анализу процессов в изолированных системах
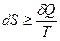 Q=const → dS≥0 - выражение II-го закона термодинамики для адиабатного процесса.
Q=const → dS≥0 - выражение II-го закона термодинамики для адиабатного процесса.
Знак > - для необратимого процесса, характеризует протекание процессов в изолированной системе
Знак = - условие т/д равновесия в изолированной системе
Условием протекания является возрастание энтропии dS>0 (ΔS>0).
При установившемся равновесии энтропия максимальна dS=0 (d2S<0).
На основе данного вывода немецкий ученый Клаузиус сформулировал свой постулат:
Энтропия Вселенной непрерывно возрастает и при достижении max энтропии наступит тепловая смерть Вселенной. Но этот постулат не верен, так как Вселенная не является изолированной системой и к ней эти выводы не применимы.
Дата добавления: 2015-08-10; просмотров: 48 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Теплоемкость твердых тел | | | Изменение энтропии в разных процессах |