
Читайте также:
|
Докажем, что внутренняя энергия является т/д функцией системы. Внутренняя энергия согласно определению является аддитивной функцией.
U=Eпост.+Екол.+Евр.+Еэл.+…
Докажем теперь, что изменение внутренней энергии определяется только конечным и начальным состояниями ее и не зависит от пути протекания процесса. Рассмотрим пример:
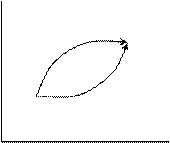 V
V
ΔU1 2
ΔU2
T
Докажем, что в любом случае ΔU1 = ΔU2
Доказательство: от противного
ΔU1 ≠ ΔU2
1) пусть ΔU1 > ΔU2
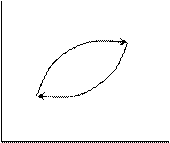 V
V
ΔU1 2
-ΔU2
T
Тогда осуществим между 1 и 2 цикл. В результате осуществления такого цикла мы будем получать выигрыш ΔU1 - ΔU2 > 0 за счет внутренней энергии системы и осуществив этот цикл сколь угодно большое число раз мы можем получить большой выигрыш в энергии. Но это не возможно, так как противоречит I-му закону термодинамики.
2) пусть ΔU2 > ΔU1
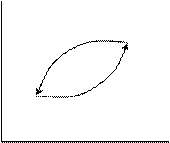 V
V
-ΔU1 2
ΔU2
T
Это также не возможно.
Поэтому ΔU1 = ΔU2, а внутренняя энергия является термодинамической функцией состояния системы.
Анализ уравнения I-го закона термодинамики
Запишем уравнение I-го закона т/д для случая, когда единственной работой процесса является работа расширения, т.е. δQ=dU+pdV (1)
1) пусть внутренняя энергия системы – функция объема и температуры U=U(V,T).
Тогда 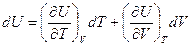 (2)
(2)
(2) в (1)
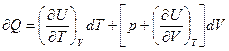 (3)
(3)


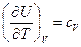 калорические коэффициенты
калорические коэффициенты
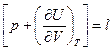
Тогда 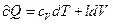 (4)
(4)
Чтобы выявить их физический смысл, проведем анализ (4):
V=const 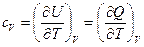 - изохорная теплоемкость системы
- изохорная теплоемкость системы
Т=const 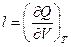 - величина показывает значение теплового эффекта при изменении объема системы на единицу при Т=const.
- величина показывает значение теплового эффекта при изменении объема системы на единицу при Т=const.
Для идеального газа в соответствии с законом Джоуля внутренняя энергия является функцией температуры и не зависит ни от объема, ни от давления газа. Поэтому 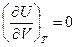 и
и 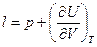 , l=p – для идеального газа.
, l=p – для идеального газа.
Таким образом, 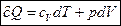 .
.
2) пусть теперь внутренняя энергия является функцией давления и температуры U=U(р,T).
Так как 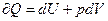 (5)
(5)
Тогда 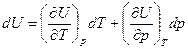 (6)
(6)
При V=V(p,T) 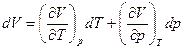 (7)
(7)
Подставим теперь (6) и (7) в (5):
получим 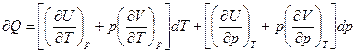 (8)
(8)
Введем обозначение:
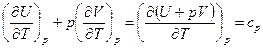 - изобарная теплоемкость
- изобарная теплоемкость
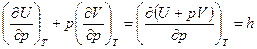 - коэффициент показывает, какое количество теплоты надо сообщить системе, чтобы изменить (увеличить) ее давление на 1.
- коэффициент показывает, какое количество теплоты надо сообщить системе, чтобы изменить (увеличить) ее давление на 1.
Тогда 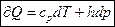 .
.
Для идеального газа в соответствии с законом Джоуля 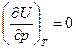 .
.
Тогда 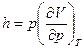 (9)
(9)
Для 1 моль идеального газа 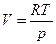 , а
, а 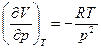 . Подставим (9) в (10):
. Подставим (9) в (10):
получим 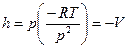 .
.
Таким образом 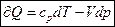 .
.
Установим взаимосвязь между теплоемкостями cp и cV. Воспользуемся для этого уравнением I-го закона термодинамики (уравнение (1)). Применим это уравнение к изобарному процессу:
Получим 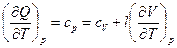 .
.
Для идеального газа l=p, а 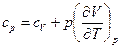
Для 1 моль идеального газа 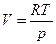
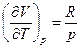 ;
; 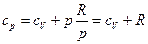 .
.
Теплоемкость при постоянном давлении всегда больше чем при постоянном объеме cp=cV+R.
Дата добавления: 2015-08-10; просмотров: 61 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Экстенсивные свойства пропорциональны массе системы (внутренняя энергия системы, ее объем, теплоемкость, энтропия и т.д.). | | | К некоторым термодинамическим процессам |