
Читайте также:
|
| Атом | Тип связи | h | K |
| C | любой | ||
| O | >C=O >C=C—O: | 1,0 2,0 | 1,0 0,8 |
| N | >C=N– >C=C—N: | 0,5 1,5 | 1,0 0,8 |
| S | >C=S >C=C—S: | 0,4 1,3 | 1,0 0,6 |
| F Cl Br I | >C=C—F: >C=C—Cl: >C=C—Br: >C=C—I: | 3,0 2,0 1,5 1,3 | 0,7 0,4 0,3 0,25 |
Можно заметить, что величины параметра h связаны с электроотрицательностями атомов, а величины параметров K — с различиями в размерах гетероатома и атома углерода, которые влияют на эффективность перекрывания АО соседних атомов.
Рассмотрим несколько примеров.
Молекула винилхлорида Н2С=СН–Cl в качестве гетероатома содержит хлор, для которого параметры Стрейтвизера равны: h = 2,0 и K = 0,4. Матрица Хюккеля, характеристическое уравнение и его корни имеют вид:
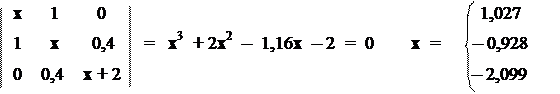
Хюккеллевские МО удобно выражать в матричной форме (n i — заселенность i -ой МО):

С помощью этой матрицы можно вычислить характеристики молекулы.
| Атом | Средняя электронная плотность | Число поставляемых электронов | Локальный заряд | Порядок p-связи | |
| С1 | 1,034 | – 0,034 | 0,990 | ||
| С2 | 0,983 | + 0,017 | |||
| 0,137 | |||||
| Cl | 1,980 | + 0,020 |
Молекулярная диаграмма (порядки связей указаны с учетом s‑связей) имеет вид:

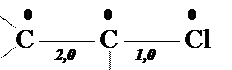
Для сравнения справа приведена молекулярная диаграмма, соответствующая классической структурной формуле молекулы винилхлорида. Легко заметить, что между классической и хюккелевской диаграммами имеются различия: изменены порядки связей и заряды атомов. С физической точки зрения, эти изменения можно рассматривать как результат "смещения" электронной плотности от атома хлора к этиленовому фрагменту. Это, разумеется, не настоящее смещение, а просто поправка, которую необходимо ввести в классическую формулу, чтобы согласовать ее с реальным распределением электронной плотности.
Такое "смещение" принято изображать кривыми стрелками, указывающими его направление. Результат введения такой поправки можно также отразить посредством т.н. неклассической структурной формулы, в которой отмечены такие особенности, как нецелочисленный порядок связей и наличие зарядов на атомах.


Отличие реальной электронной структуры молекулы от классической формулы часто обозначается терминами "мезомерный эффект" или "эффект сопряжения". Необходимость в учете таких "эффектов" химики установили на основе экспериментального изучения реакционной способности молекул и независимо от квантовой механики. Однако, метод Хюккеля (и другие, более точные методы квантовой химии) позволяют не только установить наличие такие "эффектов", но описать их количественно. (Нужно подчеркнуть, что указанные на диаграмме заряды атомов обусловлены только p-электронами.).
Располагая значениями орбитальных энергий, можно построить корреляционную диаграмму для молекулы винилхлорида

С помощью этой диаграммы можно оценить не только прочность p‑связей в молекуле, но и величину поправки на "эффект сопряжения". Так, если бы электронная пара атома хлора не участвовала в образовании p‑электронного облака, то оно было бы образовано только двумя электронами атомов углерода, и имело бы точно такой же вид, как в молекуле этилена. Энергия делокализации этих двух p‑электронов, была бы равна 2b. Энергия неподеленной электронной пары атома хлора была бы равна 2´2b. Суммарная энергия составила бы 6b. По корреляционной диаграмме легко подсчитать, что энергия делокализации 4-х электронов в реальной молекуле составляет 2´0,928b + 2´2,099b = 6,053b. В результате получим разницу в 0,053b, что и составит т.н. "энергию сопряжения" или "энергию резонанса". Величина такой поправки характеризует степень снижения реакционной способности молекулы относительно тех предсказаний, что дает нам классическая теория строения. Так, например, хорошо известно, что атомы галогенов в винилхлориде замещаются гораздо труднее, чем в насыщенной молекуле этилхлорида. Это обстоятельство хорошо согласуется с порядками связей С–Cl: Р = 1,137 в винилхлориде и Р = 1,000 в этилхлориде. Известно и множество других экспериментально обнаруженных особенностей в химическом поведении молекул, находящих объяснение с помощью метода Хюккеля.
Сероокись углерода, O = С = S. В этой молекуле имеется две системы p-связей, которые расположены во взаимно перпендикулярных плоскостях — вертикальной и горизонтальной (точками обозначены электроны):

Каждую систему следует рассматривать отдельно.
Первая система (вертикальная плоскость) может быть изображена так:

В этом случае хюккелевская матрица, характеристическое уравнение и его корни имеют вид:

Коэффициенты МО можно выразить в матричной форме:

Располагая коэффициентами МО и их заселенностями, можно вычислить локальные характеристики молекулы для первой подсистемы.
| Атом | Средняя электронная плотность | Число поставляемых электронов | Локальный заряд | Порядок p-связи | |
| O | 1,525 | – 0,525 | 0,808 | ||
| С | 0,585 | + 0,415 | |||
| 0,414 | |||||
| S | 1,889 | + 0,111 |
Вторая система (горизонтальная плоскость) имеет вид:

В этом случае хюккелевская матрица, характеристическое уравнение и его корни выглядят таким образом:

Коэффициенты МО можно выразить в матричной форме:

Располагая коэффициентами МО и их заселенностями, можно вычислить локальные характеристики молекулы для первой подсистемы.
| Атом | Средняя электронная плотность | Число поставляемых электронов | Локальный заряд | Порядок p-связи | |
| O | 1,909 | + 0,091 | 0,334 | ||
| С | 0,763 | + 0,237 | |||
| 0,911 | |||||
| S | 1,326 | – 0,326 |
Для того чтобы найти суммарные параметры молекулы, необходимо сложить величины, соответствующие отдельным подсистемам:
| Атом | Средняя электронная плотность | Число поставляемых электронов | Локальный заряд | Порядок p-связи | |
| O | 3,434 | – 0,434 | 1,142 | ||
| С | 1,348 | + 0,652 | |||
| 1,325 | |||||
| S | 3,215 | – 0,215 |
Теперь можно построить суммарные диаграммы — молекулярную:

и корреляционную:

В заключение следует отметить, что у метода Хюккеля имеется ряд существенных недостатков, которые ограничивают область его применимости. Во-первых, это возможность расчета только p-электронных свойств молекул. Во-вторых, полуэмпиричность метода приводит к необходимости экспериментального определения величины резонансного интеграла b. Опыт показывает, что оценки этой величины, получаемые данных различных экспериментальных методов, плохо согласуются между собой. В результате, для каждой конкретной задачи приходится подбирать свое собственное значение этого интеграла.
Вопросы для самоконтроля
1. Сформулируйте приближения, используемые в методе Хюккеля. Почему метод Хюккеля не требует выполнения итерационной процедуры при решении уравнений Хартри-Фока-Рутана?
2. Какие закономерности в рядах линейных полиенов и аннуленов можно выявить с помощью метода Хюккеля?
3. Дайте определение понятий "ароматичность" и "антиароматичность" в методе Хюккеля, сформулируйте "правило Хюккеля". Какими характерными химическими свойствами отличаются ароматические и антиароматические молекулы?
4. Каким образом метод Хюккеля можно распространить на гетероатомные молекулы? Каков физический смысл вводимых поправок h и K?
5. Дайте определение понятий "мезомерный эффект" и "эффект сопряжения". Как эти эффекты можно оценить количественно?
Дата добавления: 2015-07-20; просмотров: 117 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Молекулы с гетероатомами в методе МОХ | | | Метод ЛМО |