
Читайте также:
|
344 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 больных (12 %). Начиная со 2-х суток и до конца лечения в группе больных, получавших рабепразол, по сравнению с 1-й и 2-й группами было достоверно меньшее количество больных, нуждавшихся в обезболивающей терапии (р < 0,05).
больных (12 %). Начиная со 2-х суток и до конца лечения в группе больных, получавших рабепразол, по сравнению с 1-й и 2-й группами было достоверно меньшее количество больных, нуждавшихся в обезболивающей терапии (р < 0,05).
По данным суточного мониторирова-ния рН желудочного содержимого (I этап пролонгированной рН-метрии) гипо- и анацидных состояний у больных ХП мы не выявили (рис. 6.9). Гиперацидность отмечена у 60, 56,5 и 64 %
больных соответственно в 1-й, 2-й и 3-й группах. Отмечено выраженное закисление двенадцатиперстной кишки, средний рН в двенадцатиперстной кишке составил 2,4 ± 0,75.
Длительность латентного периода (II этап пролонгированной рН-мет-рии); (рис. 6.10) при первичном приеме омепразола составила 157,3 ± 14,2 мин; при приеме рабепразола — 67,5 ± 5,3 мин (р < 0,05). Продолжительность действия препаратов с интрагастральным рН > 4 в 1-е сутки лечения составила 504,2 ± 67,8 мин, 910,2 ± 37,2 мин и 1020,4 ± 27,0 мин соответственно в 1-й, 2-й и 3-й группах; продолжительность действия рабепразола была достоверно выше, чем омепразола в дозировке как 20 мг, так и 40 мг (р < 0,05).
При контрольном рН-мониторировании через 10 дней от начала антисекреторной терапии (рис. 6.11) продолжительность действия препаратов

| Глава 6. Лечение хронического панкреатита • 345 |

 по времени с интрагастральным рН > 4 увеличилась и составила 577,0 ± 47,6; 1070,9 ± 29,8 и 1330,5 ± 24,1 мин соответственно. Продолжительность действия рабепразола при курсовом приеме также достоверно увеличилась (р < 0,05) и продолжала значимо превышать аналогичный показатель в группах, получавших омепразол в дозировке как 20 мг, так и 40 мг (р < 0,05). Следует отметить, что рН < 2 на фоне терапии отмечен только в 1-й группе.
по времени с интрагастральным рН > 4 увеличилась и составила 577,0 ± 47,6; 1070,9 ± 29,8 и 1330,5 ± 24,1 мин соответственно. Продолжительность действия рабепразола при курсовом приеме также достоверно увеличилась (р < 0,05) и продолжала значимо превышать аналогичный показатель в группах, получавших омепразол в дозировке как 20 мг, так и 40 мг (р < 0,05). Следует отметить, что рН < 2 на фоне терапии отмечен только в 1-й группе.
Достоверно более выраженный и продолжительный эффект париета приводил к повышению рН в желудке и нормализации рН в двенадцатиперстной кишке, блокируя один из ведущих механизмов гиперстимуляции ПЖ (холецистокинин-секретиновый), что и определяло более выраженное снижение интенсивности и купирование болевого абдоминального синдрома. Дополнительными механизмами, сопутствующими вышеуказанному, можно считать также купирование явлений гастродуоденита за счет более выраженного и стабильно стойкого повышения гастродуоденального рН, а также своевременную активацию полиферментных препаратов непосредственно в двенадцатиперстной кишке, воздействующих по механизму отрицательной обратной связи на панкреатическую секрецию. Следует отметить, что ни в одном из случаев каких-либо побочных действий рабепразола нами отмечено не было.
У всех больных ХП имелось исходное достоверное повышение (по срав-
|
| 346• ХРОНИЧЕСКИЙ ПАНКРЕАТИТ |
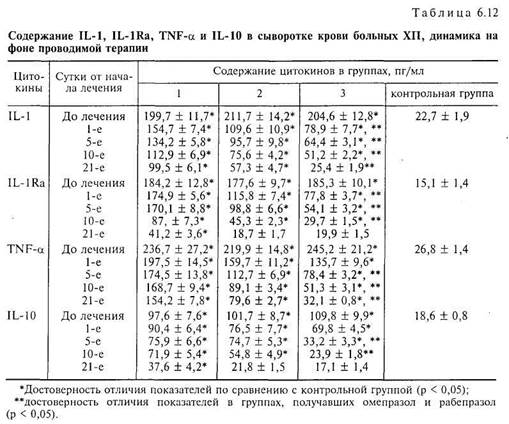
нению с контрольной группой) сывороточных концентраций исследуемых цитокинов: IL-1 и IL-10, антагониста рецепторов интерлейкина 1 (IL-IRa), фактора некроза опухоли (TNF-oc). На фоне терапии во всех группах отмечена позитивная тенденция к снижению плазменных концентраций про-воспалительных и регуляторных цитокинов (табл. 6.12), наиболее отчетливо проявляющаяся в 3-й группе. Так, по истечении 1-х суток от начала лечения в 3-й группе отмечено достоверно более выраженное снижение IL-1 по сравнению с 1-й и 2-й группами (р < 0,05). Аналогичная картина прослеживается на фоне всего периода лечения, к окончанию 3-й недели терапии уровень IL-1 приблизился к контрольным значениям, в то время как в 1-й и 2-й группах показатель оставался повышенным в 4 и 2 раза соответственно.
Нами отмечено более чем десятикратное увеличение IL-IRa до начала проводимой терапии во всех группах; на фоне лечения отмечено достоверное его снижение уже по окончании 1-х суток во 2-й и 3-й группах по сравнению с исходными значениями (р < 0,05). Однако в 3-й группе снижение показателя на 1-е, 5-е и 10-е сутки было достоверно более быстрым, чем в 1-й и 2-й группах (р < 0,05), только к окончанию лечения показатели IL-IRa во 2-й и 3-й группах сблизились с контрольными, в то время как в 1-й группе оставались выше контрольных почти в 3 раза. Отмечена прямая корреляционная связь между редукцией болевого абдоминального синдрома и уровнями IL-1 и IL-IRa в крови больных ХП, получавших в составе комплексной терапии рабепразол (г = 0,74 и г = 0,68; р < 0,05).
Глава 6. Лечение хронического панкреатита • 347
 Наиболее выраженное снижение TNF-a отмечено во 2-й и 3-й группах, однако показатели в 3-й группе, начиная с 5-х суток лечения, были достоверно более низкими по сравнению не только с 1-й группой, но и со 2-й (р < 0,05). Несмотря на столь позитивную динамику, к окончанию проводимой терапии ни в одной из групп средние значения сывороточной концентрации TNF-a не достигли контрольных значений, достоверно от них отличаясь (р < 0,05).
Наиболее выраженное снижение TNF-a отмечено во 2-й и 3-й группах, однако показатели в 3-й группе, начиная с 5-х суток лечения, были достоверно более низкими по сравнению не только с 1-й группой, но и со 2-й (р < 0,05). Несмотря на столь позитивную динамику, к окончанию проводимой терапии ни в одной из групп средние значения сывороточной концентрации TNF-a не достигли контрольных значений, достоверно от них отличаясь (р < 0,05).
Анализируя динамику IL-10, можно отметить, что к 5-м суткам от начала лечения уровень IL-10 достоверно снизился во всех группах, однако в 3-й группе отмечена более выраженная динамика показателя, уровень которого достоверно отличался от значений IL-10 в 1-й и 2-й группах (р < 0,05). Аналогичная тенденция отмечена и на 10-е сутки, к моменту окончания лечения уровени IL-10 во 2-й и 3-й группах сблизились с контрольными значениями и достоверно не различались.
Повышение в крови панкреатических ферментов отмечено у 82,4 % больных. Панкреатическая амилаза крови до начала лечения была достоверно повышена по сравнению с контрольными значениями — 135,4 ± 15,9 против 72,5 ± 13,6 ед/л в контроле (р < 0,05). По истечении 1-х суток от начала лечения во всех группах отмечена недостоверная тенденция к снижению показателя. Нормализация панкреатической амилазы отмечена к 5-м суткам во 2-й и 3-й группах, и к концу 3-й недели лечения — в 1-й группе. Исходный уровень липазы был повышен до 386,2 ± 32,7 ед/ л; на фоне терапии отмечено снижение показателя во всех группах, достигшее уровня контрольных значений к 10-му дню только в 3-й группе, в то время как в 1-й и 2-й группах уровни липазы к окончанию лечения достоверно превышали контрольные значения.
Более выраженная редукция плазменных концентраций маркеров воспаления ПЖ на фоне приема ингибиторов протонной помпы происходит из-за уменьшения панкреатической секреции вследствие описанных выше механизмов (холецистокинин-секретиновый и повышение активности кап-сулированных ферментных препаратов в двенадцатиперстной кишке при рН > 5,5). Длительное действие и наиболее выраженный антисекреторный эффект париета способствуют более адекватной реализации вышеуказанных механизмов.
Повышение в крови иммунореактивного трипсина отмечалось у 70,6 % больных, средние значения его активности составили 88,9 + 10,6 мкг/л, достоверно превысив контрольный показатель (32,7 ± 3,8; р < 0,05). На фоне лечения отмечена недостоверная тенденция к снижению активности трипсина до 74,2 ± 9,6, при анализе средних значений показателя по группам также не отмечено достоверно значимых различий его величин, что, по-видимому, было связано с использованием заместительной полиферментной терапии.
Таким образом, по результатам проведенных нами исследований можно сделать следующие выводы [78]:
Использование рабепразола в комплексной терапии обострения ХП безопасно и высокоэффективно за счет наиболее раннего, длительного и стойкого угнетения желудочного кислотообразования.
На фоне использования рабепразола отмечена более быстрая редукция болевого абдоминального синдрома, биохимических и иммунологических маркеров воспаления ПЖ.
С учетом полученных данных можно рекомендовать рабепразол в суточной дозе 20 мг для включения в схему комплексной терапии обострения ХП.
348 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 Таким образом, антисекреторные препараты необходимо вводить в схему комплексного лечения обострения ХП, поскольку они существенно уменьшают выраженность болевого абдоминального синдрома. Кроме того, нам удалось показать, что сама интенсивность болевого абдоминального синдрома у больных ХП может расцениваться как своеобразный маркер состояния гиперацидности [91].
Таким образом, антисекреторные препараты необходимо вводить в схему комплексного лечения обострения ХП, поскольку они существенно уменьшают выраженность болевого абдоминального синдрома. Кроме того, нам удалось показать, что сама интенсивность болевого абдоминального синдрома у больных ХП может расцениваться как своеобразный маркер состояния гиперацидности [91].
В то же время необходимо отметить, что у исследованных пациентов был достаточно эффективен и омепразол в суточной дозе 40 мг. Это позволяет рекомендовать и его применение, особенно ввиду значительно меньшей стоимости (хелол, 40 мг в сутки; Yamanouchi Europe). Вместе с тем нами пока не найдены контролируемые фармакоэкономические исследования, сравнивающие схемы применения омепразола и рабепразола.
6.2.1.6. Другие подходы к купированию боли при хроническом панкреатите
При отработке тактики лечения болевого абдоминального синдрома у больных ХП необходимо учитывать наличие нарушений моторики желчного пузыря, модификация которой обеспечивает нормальный пассаж секрета ПЖ. Гипермоторные нарушения требуют назначения спазмолитиков — бускопана, но-шпы, галидора и др., при гипомоторных нарушениях применяют прокинетики — метоклопрамид и домперидон в терапевтических дозах до периода стабилизации моторики. В последнее время широко используются комбинированные препараты с холеретическим и спазмолитическим действием — одестон, гепабене, гепатофальк, обладающие также и гепатостабилизирующим эффектом, что особенно показано для профилактики полипрагмазии — нередкой ситуации в практике панкреатолога.
Отток желчи и панкреатического секрета может быть затруднен вследствие воспаления большого дуоденального сосочка, что требует назначения антибактериальной терапии с использованием полусинтетических пе-нициллинов, препаратов тетрациклинового ряда, цефалоспоринов, макро-лидов, выделяющихся в достаточных концентрациях с желчью.
При дисфункции сфинктера Одди и дискинетических расстройствах кишечника, играющих, как известно, немалую роль в генезе болевого абдоминального синдрома у больных ХП, хороший эффект показал селективный миотропный спазмолитик мебеверин (дюспаталин, Solvay Pharma). Препарат обладает двойным механизмом действия — блокирует натриевые каналы клеточных мембран и поступление натрия и кальция в клетку, а также — депо кальция, ограничивая выход калия из клетки, что препятствует развитию гипотонии (рис. 6.12). Поэтому при приеме дюспаталина не отмечается развития атонии кишечника, наблюдаемой, в ряде случаев, при применении других спазмолитиков.
Таким образом, терапевтические дозы мебеверина гидрохлорида обеспечивают эффективное спазмолитическое действие на желудочно-кишечный тракт и бил парную систему [69, 84]. Высокая селективность в отношении гладкой мускулатуры ЖКТ и отсутствие системных побочных эффектов позволяют использовать дюспаталин у самого широкого круга пациентов, в том числе и при лечении больных, имеющих сопутствующие заболевания сердечно-сосудистой системы, глаукому, аденому предстательной железы [24]. По экспериментальным данным, мебеверин в короткий срок нормализует моторную функцию билиарного тракта, моторику сфинктеров и сократительную способность желчного пузыря, способствует снижению ли-
Глава 6. Лечение хронического панкреатита • 349
 тогенных свойств желчи и улучшению ее коллоидной стабильности [81]. Соответственно, отмечен хороший эффект мебеверина в лечении функциональных расстройств и купировании боли у больных желчнокаменной болезнью [41] и после холецистэктомии [39, 81], при остром холецистите, холедохолитиазе и ОП [24], что в целом открывает новые возможности применения дюспаталина в панкреатологии, особенно у пациентов с билиарно-зависимыми формами ХП.
тогенных свойств желчи и улучшению ее коллоидной стабильности [81]. Соответственно, отмечен хороший эффект мебеверина в лечении функциональных расстройств и купировании боли у больных желчнокаменной болезнью [41] и после холецистэктомии [39, 81], при остром холецистите, холедохолитиазе и ОП [24], что в целом открывает новые возможности применения дюспаталина в панкреатологии, особенно у пациентов с билиарно-зависимыми формами ХП.
Важнейшим свойством мебеверина является практически полное отсутствие побочных эффектов, обусловленное в большей степени его селективностью [255, 426], что позволяет применять его длительно.
Нами было обследовано 19 больных ХП (средний возраст 57,3 года), у которых по данным эластазного теста и копрологического анализа выявлена недостаточность экзокринной функции ПЖ тяжелой степени (1-я группа). Все больные 1-й группы по достижении клинико-инструментальной ремиссии после выписки из стационара получали в течение 6 мес дюспата-лин 400 мг/сут и креон 150 000 ед/сут. Группу сравнения составили 17 больных ХП с экзокринной недостаточностью ПЖ тяжелой степени (2-я группа), получавшие монотерапию креоном 150 000 ед/сутки. К концу периода наблюдения у больных 1-й группы отмечались достоверно более редкие проявления симптомов кишечной диспепсии (р < 0,05). Так, дискомфорт в животе отмечали 31,6 и 94,1 % больных, схваткообразные и ко-ликообразные боли по ходу толстой кишки — 21,1 и 88,2 % больных в 1-й и 2-й группах соответственно. Представленность диарейного синдрома в группах была примерно одинаковой и статистически не различалась — у 26,3 и 35,3 % больных соответственно. Стабилизация массы тела отмечена у 15,8 и 17,6 % больных, прибавка в весе — у 63,2 и 64,7 % больных соответственно. Обострение ХП, потребовавшее стационарного лечения, развилось только у одного больного 2-й группы (5,8 %). Таким образом, при введении в состав комплексной терапии дюспаталина достоверно уменьшалась частота развития симптомов кишечной диспепсии и болевого абдоминального синдрома, способствуя улучшению качества жизни больных [59].
 Не так давно в Японии разработано новое направление в лечении болевого абдоминального синдрома у больных ХП — применение селективных блокаторов рецепторов ХК ацинарных клеток ПЖ. Эти препараты (лок-сиглюмид, девазепид и др.) за счет блокады рецепторов ХК на ацинарных клетках ПЖ резко снижают секрецию панкреацитов, а следовательно и внутрипанкреатическое давление, приводя к купированию боли [267, 313]. Хотя данных о проведенных крупномасштабных исследованиях по приме-
Не так давно в Японии разработано новое направление в лечении болевого абдоминального синдрома у больных ХП — применение селективных блокаторов рецепторов ХК ацинарных клеток ПЖ. Эти препараты (лок-сиглюмид, девазепид и др.) за счет блокады рецепторов ХК на ацинарных клетках ПЖ резко снижают секрецию панкреацитов, а следовательно и внутрипанкреатическое давление, приводя к купированию боли [267, 313]. Хотя данных о проведенных крупномасштабных исследованиях по приме-
350 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 нению селективных блокаторов рецепторов ХК нами пока не найдено, некоторые отечественные ученые считают это направление весьма перспективным [21].
нению селективных блокаторов рецепторов ХК нами пока не найдено, некоторые отечественные ученые считают это направление весьма перспективным [21].
Для лечения хронического болевого абдоминального синдрома у больных ХП в последние годы все чаще применяются малоинвазивные и эндоскопические методики [181, 219, 231, 271, 312, 402]. Показаниями к эндоскопическому лечению являются преимущественно обструктивные формы ХП, возникшие на фоне стриктур ГПП, протоковых и ампулярных конкрементов, стеноза БДС и других причин.
Считается, что альтернативой наркотическим анальгетикам является чрескожное введение под КТ- или УЗ-контролем этанола и других веществ в зону чревного сплетения; более подробно на этом мы остановимся в следующем разделе. Имеются указания на эффективность паравертебральных блокад на уровне Thv-ThX[1, блокад круглой связки печени, длительной эпидуральной блокады. Считается, что эпидуральный блок оказывает хорошее обезболивающее действие и улучшает микроциркуляцию в стенке кишечника [28, 54].
Только если все возможные консервативные методики, примененные для купирования боли, включая малоинвазивные вмешательства, исчерпаны, должны быть использованы возможности хирургического лечения. Вариант оперативного пособия выбирается в зависимости от этиологии панкреатита, клинико-инструментальной картины заболевания и предполагаемого патомеханизма боли, о чем более подробно будет изложено в разделах, посвященных эндоскопическим и хирургическим методам лечения ХП.
В заключение необходимо отметить, что при лечении болевых необ-структивных форм ХП необходимы диетотерапии и прием экзогенных панкреатических ферментов в больших дозах в комбинации с блокаторами желудочной секреции, при необходимости назначаются ненаркотические анальгетики. Если данная последовательность консервативных мероприятий оказывается неэффективной, возникают показания для чрескожной блокады чревного сплетения. При неэффективности вышеуказанных этапов рекомендуется оперативное лечение.
6.2.1.7.
Алгоритмы купирования боли при хроническом панкреатите
Практическому врачу достаточно сложно разобраться в огромном перечне различных препаратов, применяемых для купирования боли у больных ХП. Поэтому мы сочли необходимым дать наиболее известные и адекватные, на наш взгляд, алгоритмы, упрощающие и стандартизирующие работу врачей в условиях современной медицины.
В первую очередь необходимо привести алгоритм, рекомендованный ВОЗ для лечения панкреатической боли [439]. Следует отметить, что данный алгоритм в настоящий момент можно считать несколько устаревшим, поскольку он разрабатывался с позиций медицины, основанной на доказательствах, с учетом данных о патофизиологии боли и эффективности различных препаратов, имевшихся 15 лет назад:
Ступень 1: этиотропная терапия, включая лечение алкоголизма, диета.
Ступень 2а: периферические анальгетики (парацетамол).
Ступень 26: периферические + слабодействующие центральные анальгетики (трамал, стадол).
Глава 6. Лечение хронического панкреатита • 351


|
Ступень 2в: ступень 2а + нейролептик или антидепрессант.
 Ступень 3: опиои-ды, факультативно ограниченные ступенью 2а.
Ступень 3: опиои-ды, факультативно ограниченные ступенью 2а.
В 1998 г. Американская гастоэнтеро-логическая ассоциация предложила алгоритм лечения ХП с болевым синдромом, ориентируя врача на выбор оперативной или консервативной коррекции заболевания по результатам диагностических тестов (рис. 6.13) [139].
Для купирования боли рекомендуется прием высокой дозы традиционных полиферментных препаратов в сочетании со средствами, ингиби-рующими желудочную секрецию. При неэффективности вышеуказанных мероприятий проводится выбор между продолжительным приемом наркотических анальгетиков и инвазивным лечением. Согласно классическим представлениям, для купирования болевого синдрома следует применять полиферментные препараты в сочетании с антисекреторными средствами как для защиты ферментов от разрушения под действием желудочного сока, так и для создания физиологического «покоя» железы [151, 171].
6.2.2. Консервативная терапия отечной формы хронического панкреатита
Больные с отечным (интерстициальным) панкреатитом должны лечиться в хирургическом отделении, однако в клинической практике бывает трудно выявить отечные изменения ПЖ, особенно при отсутствии панкреатической гиперферментемии, и больные нередко оказываются в терапевтических и гастроэнтерологических отделениях стационаров. Поэтому всем больным ХП с малейшим подозрением на развитие отечно-интерстициаль-ных изменений ПЖ показана базисная терапия. Если на фоне провидимого базисного лечения состояние больного не улучшается в течение 48— 72 ч, появляются признаки эндогенной интоксикации и органной дисфункции, то следует заподозрить развитие деструктивных изменений в ПЖ.
В целом, консервативная терапия отечно-интерстициальной формы ХП (можно рассматривать как эквивалент обострения ХП) должна обеспечивать решение следующих основополагающих задач:
1. Создание функционального покоя ПЖ и блокирование экзокринной
функции pancreas с последующей постепенной подготовкой органа к
функциональным нагрузкам.
2. Купирование болевого синдрома и предотвращение прогрессирова-
352 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 ния отечно-интерстициальной формы ХП во избежание развития деструктивного панкреатита и хирургических осложнений.
ния отечно-интерстициальной формы ХП во избежание развития деструктивного панкреатита и хирургических осложнений.
3. Дезинтоксикационная терапия.
4. Коррекция катаболических процессов.
5. Профилактика инфекционных осложнений.
6. Коррекция эндокринной недостаточности ПЖ.
6.2.2.1. Блокада экзокринной функции и создание
функционального покоя поджелудочной железе
Ведущим направлением медикаментозного воздействия при обострении ХП является уменьшение секреторного напряжения ПЖ с уменьшением объема панкреатического сока и концентрации в нем ферментов, так как ведущая роль в патогенезе обострения и формировании клинических симптомов и осложнений принадлежит повреждающему действию собственных протеолитических ферментов (трипсиногена, химотрипсина, проэла-стазы и фосфолипазы А), что ведет к отеку ПЖ с последующим развитием коагуляционного некроза и фиброза. Снижение внешнесекреторной функции ПЖ должно приводить к созданию «функционального покоя» железы, уменьшению протокового и тканевого давления и редукции, таким образом, болевых ощущений. Достигнуть это можно прямым подавлением панкреатической секреции и опосредованно через ингибирование синтеза соляной кислоты, которое приводило бы к уменьшению образования секретина и, в определенной мере, ХК [282]. Теоретические положения для данного утверждения были положены еще сотрудниками лаборатории И. П. Павлова — И. Л. Долинским и Л. Д. Попельским, открывшими в 1894—1896 гг. наличие тесной сопряженности между панкреатической секрецией и соляной кислотой, поступающей из желудка в двенадцатиперстную кишку. В дальнейшем были выделены эффекторные субстанции — гормоны секретин и ХК, оказывающие стимулирующее влияние на ПЖ.
Одним из главных направлений для создания функционального покоя ПЖ, как было указано выше, является классический подход в лечении — назначение голода на 2—5 сут с постепенным переходом на 1-й вариант диеты 5 п. С учетом высокой потребности в микро- и макронутриентах у больных отечной формой ХП целесообразна нутритивная поддержка — эн-теральное зондовое (тонкокишечное) и/или парентеральное питание, применение которых не вызывает секреторного напряжения ПЖ.
Существуют данные, что внутривенное и внутриартериальное введение панкреатической рибонуклеазы в дозе 2—3 мг/кг массы тела нормализует биосинтетические процессы в ациноцитах и создает функциональный покой органа. Кроме того, препарат оказывает отчетливое болеутоляющее действие, снижает ферментную токсемию, уменьшает развитие парапан-креатических осложнений [28]. К сожалению, препарат крайне дефицитен в России.
 На сегодняшний день основным лечебным воздействием, направленным на уменьшение давления в протоковой системе ПЖ за счет непосредственного влияния на функциональную активность органа, а также за счет уменьшения желудочной секреции (подавление секреции гастрина), является применение синтетического аналога соматостатина — октреоти-да [16, 83]. Считается, что применение синтетических аналогов соматостатина (сандостатина, октреотида, стиламина) может являться и профи-
На сегодняшний день основным лечебным воздействием, направленным на уменьшение давления в протоковой системе ПЖ за счет непосредственного влияния на функциональную активность органа, а также за счет уменьшения желудочной секреции (подавление секреции гастрина), является применение синтетического аналога соматостатина — октреоти-да [16, 83]. Считается, что применение синтетических аналогов соматостатина (сандостатина, октреотида, стиламина) может являться и профи-
Глава 6. Лечение хронического панкреатита • 353
 лактической мерой развития деструктивных и осложненных форм панкреатита [28].
лактической мерой развития деструктивных и осложненных форм панкреатита [28].
Октреотид нормализует спланхнический кровоток, стабилизирует мембраны ацинарных клеток, стимулирует активность ретикулоэндотелиаль-ной системы и играет регуляторную роль, в основном ингибирующую, в модулировании иммунной реакции через аутокринные и нейроэндокрин-ные каналы. Установлена способность соматостатина блокировать высвобождение цитокинов периферическими мононуклеарными клетками.
Сандостатин (октреотид, Novartis) вводят по 50—100 мг подкожно с интервалом 8—12 ч на протяжении 2—3 дней. Стиламин (соматостатин ацетат, Ares-Serono) в связи с коротким периодом полувыведения (2—3 мин) назначают в виде непрерывной инфузии: его вводят на протяжении 12 ч через отдельный инфузионный тракт в центральную вену со скоростью 3— 3,5 мкг/кг массы тела больного в час, т. е. в среднем взрослому пациенту вводится 250 мкг/ч. Стиламин и октреотид улучшают общее состояние больного, стабилизируют показатели гемодинамики, разрешают кишечный парез, нормализуют высокие показатели амилазы в моче и крови.
Сроки, дозы и кратность введения зависят от тяжести процесса, эффективности и переносимости препарата. Возникновение побочных эффектов вследствие резкого подавления функциональной активности ПЖ, таких как резкое вздутие живота, послабление стула следует купировать полиферментными препаратами и уменьшением дозы октреотида или его отменой [74, 83].
Необходимо отметить, что в последнее время стали появляться данные, свидетельствующие о некоторой переоценке эффектов октреотида. Так, в недавнем метаанализе, посвященном сравнению эффективности человеческого соматостатина (6 исследований) и октреотида (7 исследований) при лечении ОП, было показано, что такой важный показатель, как снижение смертности, отмечен только при лечении нативным соматостатином [423].
Сообщается, что регуляторный пептид 5-лейэнкефалина — даларгин угнетает панкреатическую и желудочную секрецию, способствует активной регенерации тканей ПЖ и слизистой оболочки желудка, обладает обезболивающим и гепатопротекторным действием, подавляет экзокринную функцию ПЖ и желудочную секрецию. При приеме внутрь он разрушается кислым содержимым желудка, поэтому вводится только парентерально. Взрослым—1—2 мг препарата вводят внутримышечно 2 раза в сутки, предварительно разведя его в 1 мл 0,9 % раствора хлорида натрия.
В первые часы заболевания, особенно при ОП и обострениях ХП тяжелой степени, сопровождающихся выраженной гиперферментемией и наличием мультиорганных поражений, рекомендуют внутривенное применение поливалентного ингибитора протеаз апротинина (гордокс, контрикал, тра-силол), инактивирующего циркулирующие в кровотоке панкреатические ферменты [21, 28, 56, 74, 130]. Однако при ХП их эффективность сомнительна; большинство проводимых исследований не подтвердили их терапевтического эффекта [82, 131]. Существуют указания, что эффективность ингибиторов протеаз не отличается от эффекта плацебо [122, 175], что объясняется отсутствием дефицита эндогенных протеаз при атаке панкреатита [98]. В то же время необходимо отметить, что в последнее время большое количество публикаций указывает на то, что апротонин является в большей степени антикининовым, а не антитрипсиновым средством, эффективно снижающим в периферической крови активность калликреина с последующим уменьшением синтеза брадикинина [21, 130, 131]. По мнению Н. Б. Губергриц, именно этот механизм позволяет рекомендовать апрото-
| 354• ХРОНИЧЕСКИЙ ПАНКРЕАТИТ |

нин при гиперферментемических панкреатитах, поскольку данный препарат предотвращает «кининовый взрыв» в первые часы атаки панкреатита, и, по мнению автора, купирует боль. Итоговые аргументы «за» и «против» естественных ингибиторов протеаз приведены в табл. 6.13.
Начальная доза контрикала (апротонина) составляет 100—200 тыс. ЕД, суточная — 300—400 тыс. ЕД препарата. Можно применять контрикал в виде парентерально вводимых смесей следующего состава [131, 247, 130]:
1. Апротонин 30—50 тыс. ЕД, гепарин 5 тыс. ЕД, прокаин 0,25 % —
200,0 мл, реополиглюкин 100 мл, атропина сульфат 0,1 % — 1,0 мл, дифен-
гибрамин 1 % — 2,0 мл, промедол 2 % — 2,0 мл (для внутривенных ин-
фузий).
2. Апротонин 20 тыс. ЕД, прокаин 0,25 % — 100,0 мл, физиологический
раствор NaCl — 100 мл, промедол 2 % — 1,0 мл, фторафур 4 % — 20 мл, ге
парин 10 тыс. ЕД, преднизолон и октреотид (для внутриартериальных ин-
фузий).
Начальная доза трасилола равна 500 тыс. ЕИК, а затем его вводят внутривенно медленно по 200 тыс. ЕИК с интервалом 4 ч. Гордокс вначале вводят внутривенно капельно в дозе 500 тыс. ЕД, а затем по 50 тыс. ЕД каждый час, суточная доза составляет 1,5 млн. ЕД. В последующие 5—7 дней дозу гордокса уменьшают до 300 тыс. ЕД. Мощным ингибитором протеаз является габексата мезилат, 100 мг препарата разводят в 500 мл 5 % раствора глюкозы или Рингера и вводят со скоростью 7—8 мл в минуту 1—3 раза в сутки. Считается, что введение ингибиторов протеаз на более поздних стадиях течения заболевания и в меньших дозировках не только экономически невыгодно, но и патогенетически не обосновано [28].
Следует отметить, что из всех приведенных блокаторов протеаз только габексат — низкомолекулярный ингибитор трипсина — проникает в паренхиму ПЖ и парапанкреатические ткани, блокируя активированные протеа-зы. Препарат назначают по 100 мг внутривенно капельно на 500 мл 5 % глюкозы в течение 7—10 дней от начала атаки панкреатита.
Остальные препараты не оказывают никакого воздействия на панкреатическую секрецию, возможно, связывая ферменты только в сыворотке крови [424]. Кроме того, контрикал, гордокс, трасилол являются естественными ингибиторами протеаз, т. е. они изготавливаются из ПЖ, слюнных желез и легких животных. Соответственно, все эти препараты содержат «балластный» чужеродный белок, очень часто оказывая аллергические
Дата добавления: 2015-10-21; просмотров: 61 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Фармакотерапия 2 страница | | | Фармакотерапия 4 страница |