
Читайте также:
|
Главной целью консервативной терапии ХП является уменьшение и/или купирование болевого абдоминального синдрома и предотвращение или компенсация функциональной панкреатической недостаточности [35, 80, 86, 98].
6.2.1. Купирование боли
Купирование боли является наиболее важной задачей в лечении ХП и опирается на следующие основополагающие мероприятия: исключение алкоголя и табакокурения, лечебное питание, заместительная терапия ферментными препаратами, не содержащими желчных кислот, назначение блокаторов Н2-рецепторов гистамина, ингибиторов протонной помпы, ан-тацидных препаратов, избирательных или неизбирательных секвестрантов желчных кислот, а также применение анальгетиков, спазмолитиков и нейролептиков.
В первую очередь при рецидиве болевого абдоминального синдрома у больного ХП, особенно при его атипичности и отсутствии эффекта от стандартной терапии, необходимо оценить «свежие» структурные изменения ПЖ (воспаление, псевдокисты, папиллиты, стриктуры или камни, объемные образования), что в целом и будет определять дальнейшую тактику ведения больного — продолжение и/или модификация фармакотерапии, эндоскопическое или хирургическое лечение [353, 354].
Глава 6. Лечение хронического панкреатита • 325
 6.2.1.1. Диета и исключение алкоголя
6.2.1.1. Диета и исключение алкоголя
В комплексной терапии болевого абдоминального синдрома у больных ХП необходимо строжайшее соблюдение диеты (см. раздел 6.1), исключение алкоголя и табакокурения.
Действительно, достаточно давно существует важнейший клинический афоризм, гласящий, что прекращение приема алкоголя уменьшает частоту и выраженность болевого абдоминального синдрома у больных хроническим алкогольным панкреатитом. Известно сообщение J. E. Trapnell, в котором говориться о существенном уменьшении выраженности болевого абдоминального синдрома у IS % пациентов с хроническим алкогольным панкреатитом, отказавшихся от употребления алкоголя [420].
Как мы указывали ранее, патогенез развития панкреатита на фоне приема алкоголя не до конца ясен и, возможно, обусловлен комбинацией различных механизмов, включающих спазм сфинктера Одди [123, 279J, изменения качественного состава панкреатического сока с избыточным количеством белка и низкой концентрацией бикарбонатов [134, 383], угнетение биоэнергетических процессов в клетках с уменьшением их устойчивости к повреждающим влияниям и ускорением некротических процессов [22]. Однако наблюдение J. E. Trapnell в большей степени можно объяснить только стимулирующим эффектом алкоголя на панкреатическую секрецию [162].
Тем не менее, как было описано в главе 2, до сих пор однозначно не решен вопрос о ведущем значении этанола в патогенезе панкреатита в том числе — и проблема зависимости между употреблением алкоголя и болевым абдоминальным синдромом у больных ХП. Ведутся споры о том, является ли этанол прямым «провокатором» рецидивирующей боли у больных алкогольным ХП или нет. Так, Р. С. Bornman и соавт. отметили, что среди наблюдаемых ими пациентов, страдающих болевой формой панкреатита, около половины больных продолжали употреблять алкоголь. В то же время примерно такое же количество (порядка 50 %) больных ХП, не страдающих от болей, систематически употребляли алкоголь, причем в обоих случаях авторами не отмечено существенного провоцирования или утяжеления выраженности боли на фоне употребления этанола [162]. Аналогичные наблюдения были сделаны I. N. Marks и соавт. [310]. Существуют данные, что течение хронического алкогольного панкреатита непредсказуемо; у ряда больных алкогольным ХП отмечается усиление болей через 12—24 ч абстиненции, причем функциональные нарушения могут прогрессировать даже на фоне строгой абстиненции. В то же время у некоторых больных длительное время заболевание не прогрессирует даже на фоне употребления алкоголя [68].
Результаты этих наблюдений подвергают сомнению факт взаимосвязи длительного приема алкоголя и абдоминальной боли. Однако логичное объяснение результатам наблюдений Р. С. Bornman и соавт. и I. N. Marks и соавт. все же есть. Не вызывает сомнения факт, что боль при панкреатите напрямую связана с экзокринной секрецией ПЖ. У ряда пациентов с сохранной или незначительно сниженной внешнесекреторной функцией ПЖ, болевой абдоминальный синдром действительно может провоцироваться приемом алкоголя, действующего как стимулятор панкреатической секреции. У больных ХП со значительно сниженной панкреатической секрецией (другими словами — с распространенным фиброзом и атрофией паренхимы ПЖ) алкоголь, естественно, уже не будет играть столь существенную роль в механизме боли. Именно это и может объяснить парадоксальный факт купирования этанолом типичной абдоминальной боли, нередко
326 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 наблюдаемый у больных с длительным анамнезом хронического алкогольного панкреатита, когда на первое место выходят другие причины болевого абдоминального синдрома, и алкоголь действует по сути как «системный анестетик».
наблюдаемый у больных с длительным анамнезом хронического алкогольного панкреатита, когда на первое место выходят другие причины болевого абдоминального синдрома, и алкоголь действует по сути как «системный анестетик».
Недавно появились данные, что пациенты с болевыми формами ХП, продолжающие курить, хуже реагируют на терапию, направленную на коррекцию боли [392], что также необходимо учитывать при выборе лечения.
6.2.1.2. Ненаркотические и наркотические анальгетики
До сих пор применение анальгетиков остается одним из главных методов купирования боли у больных ХП. При отечно-интерстициальной стадии панкреатита, т. е. при обострении ХП, анальгетики вводят парентерально, начиная с парацетамола и нестероидных противовоспалительных средств, при их неэффективности могут быть применены наркотические анальгетики, о чем будет сказано ниже.
С учетом того, что у многих больных ХП без отечных изменений со стороны ПЖ, без явлений панкреатической обструкции и осложнений панкреатита (крупные псевдокисты, свищи, дуоденальная непроходимость и др.) нередко сохраняются выраженные абдоминальные боли, обусловленные ишемией [372] и прогрессирующим фиброзом в зонах прохождения сенсорных нервов [160, 166], может потребоваться даже амбулаторная терапия анальгетиками.
Анальгетиками первого выбора являются салицилаты или ацетомино-фен, которые необходимо принимать до еды для предотвращения пост-прандиального усиления боли. Ввиду того что минимально негативным воздействием на слизистую оболочку желудка обладает парацетамол, показавший хороший эффект для купирования боли у пациентов с ХП, именно этот препарат в последние годы считается наиболее предпочтительным. Однако следует помнить, что именно парацетамол является наиболее гепа-тотоксичным из всей группы нестероидных противовоспалительных препаратов, что может ограничивать его применение у больных с сопутствующими поражениями печени, в первую очередь алкогольными.
Дозы анальгетиков подбираются индивидуально, причем должна использоваться самая низкая эффективная доза. При неэффективности ненаркотических анальгетиков возможны их применение в максимально допустимых суточных терапевтических дозах, изменение режима приема и пути введения или попытка замены препарата на другой препарат этой группы. В частности, имеются данные, что при ХП эффективны лишь высокие дозы анальгетиков; так, трамадол эффективнее в суточной дозе 800 мг, что в 2 раза превышает максимально рекомендуемую дозу [98]. Другим путем повышения эффективности обезболивающей терапии является дополнительное включение в схему психотропных препаратов (нейролептики, антидепрессанты, транквилизаторы), оказывающих как прямое аналге-зирующее, так и потенцирующее действие в отношении ненаркотических анальгетиков. Кроме того, важны и собственные эффекты этих препаратов, поскольку у многих больных наблюдаются пограничные расстройства психики, тревожно-депрессивные и другие невротические расстройства. В случаях резистентности к ненаркотическим анальгетикам могут быть применены опиаты и их синтетические аналоги. Основным ограничением к широкому применению наркотических анальгетиков является развитие лекарственной зависимости.
Глава 6. Лечение хронического панкреатита • 327
 6.2.1.3. Панкреатические ферменты в купировании боли
6.2.1.3. Панкреатические ферменты в купировании боли
Начиная с 70-х годов прошлого века было проведено несколько экспериментальных исследований, предполагающих, что внутрипросветное действие панкреатических протеаз играет важную роль в регулировании панкреатической секреции [227, 299]. Однако основная концепция регулирования обратной регуляции панкреатической секреции опиралась, прежде всего, на результаты исследований на экспериментальных животных (крысах), в которых было показано, что эвакуация панкреатического секрета из двенадцатиперстной кишки стимулирует экспрессию ХК и секрецию панкреатических ферментов. С другой стороны, внутридуоденальное введение трипсина или химотрипсина ингибируют экспрессию ХК и панкреатическую секрецию ферментов.
Позже было доказано, что увеличение уровня в плазме крови ХК и усиление панкреатической секреции после удаления панкреатического сока из двенадцатиперстной кишки обусловлено трипсин-чувствительным субстратом, секретируемым проксимальными отделами кишечника и названным впоследствии холецистокинин-рилизинг-фактор [300].
В присутствии трипсина ХК-рилизинг-фактор, являясь пептидом, разрушается и, таким образом, инактивируется. Белок пищи в тонкой кишке связывает трипсин, условно конкурируя с ХК-рилизинг-фактором за фермент, и только излишек трипсина может инактивировать ХК-рилизинг-фактор [292J. Увеличение концентрации ХК-рилизинг-фактора в просвете тонкой кишки вызывает экспрессию ХК, стимулирующего, в свою очередь, панкреатическую секрецию (рис. 6.J). К настоящему моменту идентифицировано несколько ХК-высвобождающих пептидов, в том числе пептиды, полученные из тонкокишечных экстрактов у свиней со структурой, идентичной диазепамам [241], и пептид, выделенный из дуоденального секрета крыс [404].
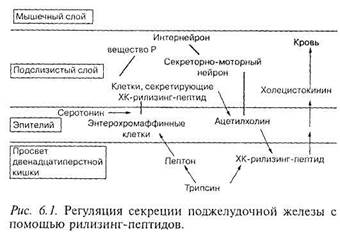
|
Аналогичный механизм обратной связи у человека был впервые описан еще в 1977 г. [252]. Действительно, в дальнейшем несколько групп исследователей подтвердили, что внутрикишечное введение трипсина или химотрипсина ингибирует секрецию ферментов ПЖ [170, 293, 336, 400]. Таким образом, представляется логичным, что у пациентов с ХП сниженная секреция панкреатических ферментов при внешнесекреторной недостаточности может приводить к гиперстимуляции ПЖ высокими уровнями ХК в плазме крови и, следовательно, к болевому абдоминальному синдрому.
В ряде дальнейших исследований, действительно, было сообщено о повышенном уровне ХК в плазме крови больных ХП [223, 390, 401J. Однако по крайней мере два других ис-
328 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 следования не выявили высокие плазменные концентрации ХК у пациентов с ХП [217, 259].
следования не выявили высокие плазменные концентрации ХК у пациентов с ХП [217, 259].
Эти факты позволили G. Isakson и I. Ihse еще в начале 80-х годов обосновать применение полиферментных препаратов с высокой протеолитиче-ской активностью для уменьшения боли при ХП посредством дуоденопан-креатического механизма обратной связи [256]. Авторы по данным проведенного двойного слепого перекрестного исследования сообщили, что на фоне приема полиферментных препаратов у больных ХП происходит снижение выраженности болевого абдоминального синдрома на 30 %. При этом у 15 из 19 больных отмечено уменьшение числа болевых приступов [256]. Однако следует отметить, что данный подход оказался эффективным только у пациентов с умеренной панкреатической недостаточностью.
J. I. Slaff и соавт. в рамках двойного слепого перекрестного исследования наблюдали 20 пациентов с болевой формой ХП [400]. Уменьшение выраженности болевого абдоминального синдрома на фоне приема полиферментных препаратов наблюдалось у 9 пациентов с легкой и умеренно выраженной экзокринной недостаточностью ПЖ, в то время как аналогичный эффект отмечен только у 2 из 11 больных ХП с тяжелой внешнесекре-торной недостаточностью pancreas. Необходимо отметить, что большинство больных, ответивших на лечение ферментами, были женщинами с идиопатическим ХП, тогда как резистентными оказались преимущественно пациенты с алкогольным ХП [400].
Хороший эффект при назначении ферментов у больных болевой формой ХП был также сообщен D. J. Ramo и соавт. [370]. В целом, результаты приведенных выше трех двойных слепых исследований оказались весьма позитивными, хороший результат применения полиферментных препаратов у больных болевой формой ХП был достигнут в 73 % случаев (у 36 из 49 наблюдаемых пациентов) [256, 370, 400].
Однако в двойном слепом 4-недельном перекрестном исследовании, проведенном в Дании, пероральное назначение двух капсул панкреазы с каждым приемом пиши лишь незначительно уменьшало выраженность болевого абдоминального синдрома у больных ХП по сравнению с эффектом плацебо [234]. В другом мультицентровом 2-недельном плацебо-контроли-руемом исследовании было показано, что прием полиферментных препаратов в кишечнорастворимой оболочке во время еды не влияет на выраженность болевого абдоминального синдрома у больных ХП [326]. Эти результаты, по всей видимости, обусловлены тем, что ингибирование обратной связи зависит от наличия высоких концентраций протеаз именно в просвете двенадцатиперстной кишки. Поскольку энтеросолюбильные препараты достигают максимальной активности в дистальной части двенадцатиперстной кишки, они могут быть менее эффективными в разрушении ХК-рилизинг-пептидов, а следовательно, и меньше влияют на снижение уровня ХК и, соответственно, уменьшение боли [171]. Наконец, в 4-месячном двойном слепом перекрестном исследовании применялись кишечно-растворимые микросферы, активирующиеся при более низких значениях рН (> 5), чем ранее использованные микросферы (рН > 6). Несмотря на достигнутый высокий уровень трипсина в двенадцатиперстной кишке, авторами не показано никакого эффекта в отношении купирования болевого абдоминального синдрома по сравнению с плацебо у большого количества больных ХП [305]. Однако в когорты больных в исследованиях было включено небольшое число женщин, причем большинство включенных пациентов были с хроническим, часто рецидивирующим болевым абдоминальным синдромом.
Глава 6. Лечение хронического панкреатита • 329
 Таким образом, в последнее время укрепилось мнение, что для купирования боли у больных ХП рекомендовано применять таблетированные препараты панкреатина, не имеющие кислотозащитной оболочки, которые начинают активироваться в желудке и верхних отделах двенадцатиперстной кишки. Однако для защиты панкреатина от соляной кислоты эти препараты необходимо принимать с блокаторами желудочной секреции [37J. Также существует мнение, что необходимо начинать лечение неэнтеросо-любильными препаратами в высокой дозе во время приема пищи в течение нескольких недель у любого пациента с болевой формой ХП. При этом лучшие результаты достигаются при панкреатитах неалкогольной этиологии с легкой или умеренной внешнесекреторной недостаточностью ПЖ [417].
Таким образом, в последнее время укрепилось мнение, что для купирования боли у больных ХП рекомендовано применять таблетированные препараты панкреатина, не имеющие кислотозащитной оболочки, которые начинают активироваться в желудке и верхних отделах двенадцатиперстной кишки. Однако для защиты панкреатина от соляной кислоты эти препараты необходимо принимать с блокаторами желудочной секреции [37J. Также существует мнение, что необходимо начинать лечение неэнтеросо-любильными препаратами в высокой дозе во время приема пищи в течение нескольких недель у любого пациента с болевой формой ХП. При этом лучшие результаты достигаются при панкреатитах неалкогольной этиологии с легкой или умеренной внешнесекреторной недостаточностью ПЖ [417].
По данным В. Т. Ивашкина и соавт., прием панкреатина в энтеросо-любильной оболочке у больных ХП привел к достоверному купированию болевого абдоминального синдрома, причем степень уменьшения боли по результатам проведенного факторного анализа достоверно зависела от степени подавления экзокринной функции ПЖ. Кроме того, установлена зависимость между дозой ферментного препарата и динамикой купирования боли [37]. Эффективность микротаблетированных препаратов в энте-росолюбильной оболочке в отношении купирования боли объясняется авторами следующим. Во-первых, генез абдоминальной боли в определенной степени обусловлен наличием дискинетических нарушений кишечника и метеоризма, вызванных вторичными расстройствами всасывания. Во-вторых, достоверное снижение уровня эластазы кала на фоне терапии с использованием энтеросолюбильной формы панкреатина дает все основания считать, что, по крайней мере, отчасти противоболевой эффект панкреатина связан с подавлением панкреатической секреции [37].
 Возможно, что активация микротаблеток происходила в более проксимальных отделах желудочно-кишечного тракта, чем предполагалось ранее, либо функционально значимая зона регуляции секреции ПЖ не ограничивается только двенадцатиперстной кишкой и захватывает также начальные отделы тощей кишки. Действительно, авторы в схеме комплексной терапии использовали антацидные препараты, блокаторы Н2-рецепторов гиста-мина и ингибиторы протонной помпы, комплексный прием которых может повышать рН желудочного содержимого до 5 и выше. Естественно, что при интрагастральном рН выше 5 может происходить активация ферментов уже в желудке, а их галеническая форма позволяет хорошо перемешиваться с химусом, что в комплексе дает поступление активированных панкреатических ферментов в высокой концентрации уже в начальные отделы двенадцатиперстной кишки. В то же время нельзя не учитывать того факта, что параллельный прием больными блокаторов желудочной секреции и спазмолитиков также влиял на выраженность боли.
Возможно, что активация микротаблеток происходила в более проксимальных отделах желудочно-кишечного тракта, чем предполагалось ранее, либо функционально значимая зона регуляции секреции ПЖ не ограничивается только двенадцатиперстной кишкой и захватывает также начальные отделы тощей кишки. Действительно, авторы в схеме комплексной терапии использовали антацидные препараты, блокаторы Н2-рецепторов гиста-мина и ингибиторы протонной помпы, комплексный прием которых может повышать рН желудочного содержимого до 5 и выше. Естественно, что при интрагастральном рН выше 5 может происходить активация ферментов уже в желудке, а их галеническая форма позволяет хорошо перемешиваться с химусом, что в комплексе дает поступление активированных панкреатических ферментов в высокой концентрации уже в начальные отделы двенадцатиперстной кишки. В то же время нельзя не учитывать того факта, что параллельный прием больными блокаторов желудочной секреции и спазмолитиков также влиял на выраженность боли.
В исследовании, проведенном на нашей кафедре, применялся полиферментный препарат в энтеросолюбильной оболочке (Креон) в комплексной терапии боли у больных ХП [99]. В исследование было включено 117 больных ХП, в том числе 55 мужчин (47,01 %) и 62 женщины (52,99 %) со средним возрастом 51,7 ± 2,9 года.
Болевой абдоминальный синдром разной степени выраженности был отмечен у всех обследованных больных. Боль локализовалась в эпигастрии у 22 больных (18,8 %), в левом подреберье —у 14 больных (11,9 %); чаще встречался опоясывающий характер болей —у 81 больного (69,2 %). Иррадиацию в спину отмечали 52 больных (44,4 %). Наличие постоянных болей
|
|
| 330• ХРОНИЧЕСКИЙ ПАНКРЕАТИТ |
отмечали 47 человек (40,2 %), периодических — 70 больных ХП (59,8 %). Связь с приемом пищи (появление или усиление боли) отмечена в подавляющем большинстве случаев — у 112 больных ХП (95,7 %). Выраженность болевого абдоминального синдрома характеризовалась следующим: 1 балл отмечен у 12 (10,3 %) больных ХП, 2 балла - у 38 (32,5 %), 3 балла — у 45 (38,4 %), 4 балла - у 22 (18,8 %).
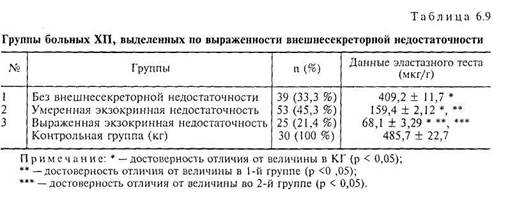
На основании результатов эластазного теста все больные ХП были разделены на 3 группы — с сохранной экзокринной функцией, с умеренно выраженной и тяжелой степенью экзокринной недостаточности (табл. 6.9).
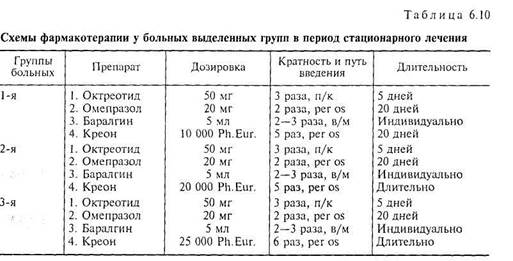
Всем больным ХП, разделенным на группы, проводилась фармакотерапия выявленной патологии по идентичным схемам с различием только по дозировке полиферментных препаратов в соответствии с имеющимися рекомендациями [86] (табл. 6.10).
Индивидуально использовался баралгин, который вводили внутримышечно 2—3 раза в день в зависимости от выраженности болевого абдоминального синдрома. Вследствие наличия болей различной степени выраженности на момент начала исследования у всех больных, баралгин в течение первых суток получали все пациенты. По мере купирования болевого абдоминального синдрома баралгин выводился из схемы терапии. Следует
Глава 6. Лечение хронического панкреатита • 331

 отметить, что по 11 человек в 1-й и 2-й группах на момент поступления характеризовались высокоинтенсивными болями в животе (4 балла), что определило необходимость использования в течение 1-х суток нейролептанал-гезии (фентанил, дропе-ридол).
отметить, что по 11 человек в 1-й и 2-й группах на момент поступления характеризовались высокоинтенсивными болями в животе (4 балла), что определило необходимость использования в течение 1-х суток нейролептанал-гезии (фентанил, дропе-ридол).
На фоне проводимой терапии отмечена отчетливая динамика к уменьшению представленности болевого абдоминального синдрома во всех группах; достоверных различий по темпам купирования болевого абдоминального синдрома в группах нами не выявлено (рис. 6.2). В целом, выбранная комплексная схема терапии,
дифференцированная по дозировке Креона в сроки до 3 нед от начала обострения позволяла купировать болевой абдоминальный синдром у 96,2-100,0 % больных [99].
В дальнейшем нами были проведены исследования с аналогичным дизайном, в которых проводилось лечение болевого абдоминального синдрома по приведенной выше схеме у больных билиарнозависимым ХП, не нуждающихся в хирургическом и эндоскопическом лечении. В течение 3 нед дифференцированной в зависимости от степени экзокринной недостаточности терапии Креоном болевой абдоминальный синдром был купирован у 98,1 % больных [75].
В заключение необходимо отметить, что перспективными являются долгосрочные сравнительные исследования, посвященные применению кислотоустойчивых и не покрытых энтеросолюбильной оболочкой ферментных препаратов в группах больных ХП, четко рандомизированных по этиологическому фактору, тяжести течения и степени экзокринной недостаточности ПЖ. Однако отсутствие подобных исследований, по всей видимости, обусловлено тем, что длительная терапия больных ХП с наличием болевого абдоминального синдрома только полиферментными препаратами невозможна по клиническим и этическим соображениям.
6.2.1.4. Соматостатин и октреотид
Соматостатин — природный гормон, одним из действий которого является ингибирование секреции ПЖ [232]. К эффектам соматостатина относят также цитопротективное действие и благоприятное влияние на ретикуло-эндотелиальную систему, что теоретически может быть полезно в лечении ХП [151, 411, 425]. Кроме того, клинические исследования показали, что соматостатин имеет антиноцицептивную активность у человека [176, 317]
332 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 и у животных [320, 384]. Таким образом, можно предположить, что этот пептид может быть эффективен в лечении болевого абдоминального синдрома у больных ХП.
и у животных [320, 384]. Таким образом, можно предположить, что этот пептид может быть эффективен в лечении болевого абдоминального синдрома у больных ХП.
Октреотид — синтетический пролонгированный аналог соматостатина, в ряде исследований показал хороший ингибирующий эффект в отношении экспрессии ХК, базальной и нервно-стимулируемой панкреатической секреции [66, 182, 288, 437]. Длительность действия октреотида проявляется при подкожном введении дозы и делает это хорошей практической альтернативой для лечения ХП по сравнению с короткодействующим нативным соматостатином. Препарат хорошо переносится, хотя длительная терапия предрасполагает к развитию холестериновых желчных камней. К сожалению, широкомасштабных контролируемых испытаний, в которых оценивался бы эффект октреотида при болевых формах ХП, до сих пор не проведено.
Короткие 3-дневные исследования с использованием 100 и 150 мг октреотида 3 раза в день не показали никакого эффекта в отношении купирования боли [306, 307]. В другом 3-дневном неконтролируемом исследовании применялся октреотид (сандостатин, Sandoz) в суточной дозе 100 мг у 15 больных болевой формой ХП, резистентных к ненаркотическим анальгетикам, спазмолитикам и ингибиторам протеаз. Положительный эффект достигнут у всех больных, причем у 53 % пациентов болевой абдоминальный синдром был купирован, у остальных больных отмечено снижение интенсивности боли [65].
В рандомизированном мультицентровом 4-недельном плацебо-контро-лируемом исследовании был применен октреотид в дозах 40—100 мг 3 раза в сутки для оценки его эффективности при ХП с выраженным болевым абдоминальным синдромом. Хотя статистически достоверных результатов в этом исследовании получено не было, октреотид в суточной дозе 600 мг оказался наиболее эффективным для купирования боли (65 % против 35 % в плацебо-группе). Кроме того, авторами было отмечено, что октреотид оказался более эффективным у больных с постоянным болевым синдромом, чем у пациентов, характеризовавшихся периодической болью [418].
Несмотря на оптимистичные результаты применения октреотида у больных болевыми формами ХП, перспективность подобных исследований ограничена существенным увеличением побочных эффектов препарата при длительном его использовании. Известно, что при длительном лечении ок-треотидом усугубляется мальдигестия за счет резкого снижения выделения ферментов ПЖ в двенадцатиперстную кишку, возможно развитие пареза кишечника и ухудшение кровоснабжения в ПЖ. Особенно осторожно применяют октреотид при желчнокаменной болезни из-за увеличения вероятности камнеобразования при создающейся на фоне лечения гипотонии желчного пузыря [21].
6.2.1.5. Антисекреторные препараты
Поскольку у ряда больных болевой абдоминальный синдром обусловлен секреторным напряжением ПЖ с увеличением объема панкреатического сока и концентрации в нем ферментов, то снижение экзокринной функции pancreas должно приводить к созданию «функционального покоя» железы, уменьшению протокового и тканевого давления и редукции, таким образом, болевых ощущений. Этого можно достичь прямым подавлением панкреатической секреции и опосредованно через ингибирование синтеза
Глава 6. Лечение хронического панкреатита • 333
 соляной кислоты, которое приводило бы к уменьшению образования секретина и в определенной мере ХК [282]. С этой целью в последние годы все чаще применяют блокаторы Н2-рецепторов гистамина [6, 49, 104, 124] и ингибиторы протонной помпы [46, 71, 74, 98]. Среди Н2-гистаминовых блокаторов предпочтение отдается квамателу [6, 49, 124], а в группе ингибиторов протонной помпы — лансопразолу [30, 83, 87, 132] и рабепразолу [21, 60, 78, 80, 110]. В целом, при проведении сравнения эффективности разных групп антисекреторных препаратов, было выявлено, что ингибиторы протонной помпы более эффективны в отношении купирования боли у больных ХП, чем блокаторы Н2-рецепторов гистамина [87, 91].
соляной кислоты, которое приводило бы к уменьшению образования секретина и в определенной мере ХК [282]. С этой целью в последние годы все чаще применяют блокаторы Н2-рецепторов гистамина [6, 49, 104, 124] и ингибиторы протонной помпы [46, 71, 74, 98]. Среди Н2-гистаминовых блокаторов предпочтение отдается квамателу [6, 49, 124], а в группе ингибиторов протонной помпы — лансопразолу [30, 83, 87, 132] и рабепразолу [21, 60, 78, 80, 110]. В целом, при проведении сравнения эффективности разных групп антисекреторных препаратов, было выявлено, что ингибиторы протонной помпы более эффективны в отношении купирования боли у больных ХП, чем блокаторы Н2-рецепторов гистамина [87, 91].
Представленный патогенетический механизм и эффективность включения антисекреторных препаратов в состав комплексного лечения ХП привели к включению ХП в число кислотозависимых заболеваний [62, 109]. Другими словами, причисление ХП к группе кислотозависимых заболеваний обусловлено тем, что эффективное лечение ХП возможно лишь при довольно длительном снижении кислотности желудочного сока. Одной из немногих проблем, возникающих при лечении панкреатитов блокаторами желудочной секреции является резистентность части больных к тем или иным антисекреторным средствам. По данным разных авторов, их частота колеблется от 11,5 до 25 % [64, 93], что требует проведения суточного мо-ниторирования рН желудочного сока для подбора наиболее эффективного препарата, его дозы и времени приема.
Остановимся подробнее на каждой группе антисекреторных средств.
Среди блокаторов Н2-рецепторов гистамина наибольший интерес вызывают препараты III поколения, к которым относится фамотидин (квама-тел и гастросидин), поскольку их действие обладает меньшим количеством побочных эффектов по сравнению со своими предшественниками и более выраженным антисекреторным действием. Хотя вопрос о целесообразности включения блокаторов Н2-рецепторов гистамина в базисную терапию ХП неоднократно обсуждался, контролируемые исследования до сих пор не проведены ни в России, ни за рубежом. Имеются только отдельные неконтролируемые исследования, посвященные применению препаратов этой группы, свидетельствующие об их эффективности [6, 49, 104, 124].
Основное действие Н2-блокаторов связано с их антисекреторным эффектом, возникающим вследствие блокады Н2-рецепторов гистамина париетальных клеток, приводящей к угнетению синтеза этими клетками соляной кислоты. Интересно отметить, что фамотидин, в отличие от цимети-дина и ранитидина, является антиоксидантом, угнетающим ПОЛ. Препарат подавляет генерацию активных форм кислорода в биологических системах, подавляет концентрацию супероксиданиона в нейтрофилах, блокирует реакции, катализируемые миелопероксидазой. Кроме того, сообщается, что фамотидин способен подавлять агрегацию тромбоцитов, улучшая таким образом реологические свойства крови. Действие блокаторов Н2-ре-цепторов гистамина опосредовано через мембранные структуры живых клеток. При этом наблюдается специфическое блокирование участков плазматической мембраны, воспринимающих стимулы, активирующие окислительный метаболизм в клетках, тогда как функция рецепторов, ответственных за хемотаксис нейтрофилов и проницаемость их мембран при терапевтических концентрациях препарата практически не затрагивается [124]. Считается, что главная мишень для антиоксидантного действия фа-мотидина — периневральное воспаление в ткани ПЖ, сопровождающееся лейкоцитарной инфильтрацией, что и объясняет его обезболивающий эф-
334 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ

 фект [5]. Следует отметить, что широкомасштабных контролируемых исследований, подтверждающих антиоксидантный эффект фамотидина, нами пока не найдено.
фект [5]. Следует отметить, что широкомасштабных контролируемых исследований, подтверждающих антиоксидантный эффект фамотидина, нами пока не найдено.
Дата добавления: 2015-10-21; просмотров: 75 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Диетотерапия и нутритивная поддержка | | | Фармакотерапия 2 страница |