
Читайте также:
|
На наш взгляд, именно комбинированное действие фамотидина и объясняет его эффективность в купировании боли у пациентов с ХП. Блока-торы Н2-рецепторов гистамина действуют достаточно эффективно, устраняя активирующее действие гистамина на секрецию соляной кислоты, однако они имеют ряд недостатков, обусловленных механизмом их действия [379]. К недостаткам блокаторов Н2-рецепторов гистамина следует отнести:
1. Н2-блокаторы связываются с рецептором обратимо, поэтому для
обеспечения эффекта необходимо, чтобы в крови постоянно поддержива
лась значительная концентрация лекарства;
2. они блокируют только один из путей активации секреции;
3. после их применения может отмечаться «рикошетная вспышка» сек
реции;
4. выраженность их эффекта определяется максимальной концентраци
ей лекарства в крови.
Наиболее эффективными ингибиторами желудочной секреции в настоящее время считаются ингибиторы протонной помпы, которые подавляют работу системы, непосредственно обеспечивающей секрецию соляной кислоты.
Как известно, секреция Н+ в слизистой оболочке желудка обеспечивается Н,К-АТФазой (протонным насосом или протонной помпой) — белком, встроенным в апикальную мембрану париетальных клеток (рис. 6.3). Протонный насос осуществляет электронейтральный обмен внутриклеточных ионов Н+ на внеклеточные ионы К+ [240]. Оба иона переносятся против градиента концентраций. Значения рН в секреторных канальцах составляют 0,8—1,0 (концентрация Н+ 10"1 М), а в клетке — около 7 (концентрация Н+ 10~7 М). Таким образом, разница в концентрации Н+ в растворах, разделенных апикальной мембраной париетальной клетки, обычно превышает 106. Транспорт ионов против градиента концентраций нуждается в энергии: протонная помпа гидролизует АТФ до АДФ и неорганического фосфата (т. е., является АТФазой) и использует освобождающуюся при этом энергию для переноса ионов.
Помимо протонной помпы в секреции соляной кислоты принимают участие также два типа каналов, расположенных в апикальной мембране (калиевый и хлорный канал) и несколько транспортных систем базолате-ральной мембраны, в частности НСО^/СГ анионообменник (см. рис. 6.3). Ионы К+, которые переносятся в клетку протонным насосом, покидают ее по градиенту концентрации вместе с ионами СП через К- и С1-каналы [397], таким образом суммарно клетка секретирует НС1. В париетальную клетку ионы СП входят через базолатеральную мембрану с использованием HCOJ/СП анионообменника [263]. Необходимые для этого обмена анионы HCOJ образуются в клетке под действием карбоангидразы (см. рис. 6.3), активность которой в париетальных клетках весьма значительна [226]. Секреция НС1 осуществляется благодаря сопряженной работе всех этих систем, однако основной движущей силой процесса является протонный насос (Н,К-АТФаза).
Н,К-АТФаза относится к семейству АТФаз Р-типа и является ближайшей родственницей Ка,К-АТФазы (Na-насоса), которая присутствует во всех клетках животных, включая и париетальную. В этих клетках Na,K-AT-Фазы в отличие от Н,К-АТФазы, присутствующей в апикальной мембране, располагается исключительно в базолатеральной мембране [70]. Н,К-АТ-
Глава 6. Лечение хронического панкреатита • 335
 Фаза состоит из двух субъединиц, одна из которых (а-субъединица) имеет молекулярную массу около 114 000 Да, а другая (р-субъединица) — около 55 000 Да [380]. Первичная структура субъединиц была определена, исходя из последовательности соответствующих генов [304, 399]. а-субъединица является каталитической, осуществляя гидролиз АТФ и формируя канал, через который ионы пересекают мембрану. р-субъединица — гликопротеин, не принимающий непосредственного участия в процессе транспорта. Однако эта субъединица, содержащая значительное количество углеводов (до '/3 от общей массы), играет важную роль в доставке вновь синтезированной а-субъединицы к апикальной мембране и в ее правильном встраивании в последнюю.
Фаза состоит из двух субъединиц, одна из которых (а-субъединица) имеет молекулярную массу около 114 000 Да, а другая (р-субъединица) — около 55 000 Да [380]. Первичная структура субъединиц была определена, исходя из последовательности соответствующих генов [304, 399]. а-субъединица является каталитической, осуществляя гидролиз АТФ и формируя канал, через который ионы пересекают мембрану. р-субъединица — гликопротеин, не принимающий непосредственного участия в процессе транспорта. Однако эта субъединица, содержащая значительное количество углеводов (до '/3 от общей массы), играет важную роль в доставке вновь синтезированной а-субъединицы к апикальной мембране и в ее правильном встраивании в последнюю.
Полипептидная цепь а-субъединицы встроена в фосфолипидную мембрану так, что ее N- и С-концы находятся внутри клетки, а сама цепь пересекает мембрану 10 раз, образуя 10 трансмембранных фрагментов. Они довольно плотно прилегают друг к другу, формируя внутри мембраны канал для переносимых катионов. Значительная часть полипептидной цепи располагается в цитоплазме, именно здесь находится центр, обеспечивающий гидролиз АТФ. Возникающие при гидролизе АТФ изменения кон-формации цитоплазматического домена передаются к каналу, что приводит к его последовательному закрыванию и открыванию с внутренней и наружной стороны клетки [240]. Особенно важную роль в формировании функционирующего канала протонного насоса играют 5-й и 6-й трансмембранные фрагменты и область между ними [321].
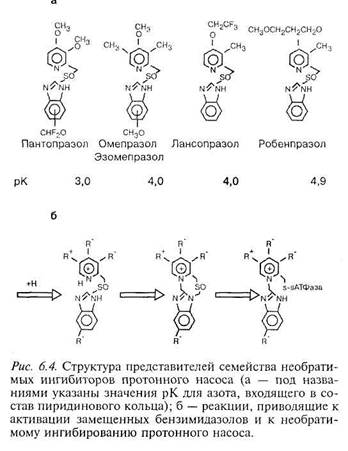
В конце 70-х годов прошлого века было обнаружено, что сульфиды пи-ридилметилбензимидазола являются ингибиторами протонного насоса [203]. Позднее они были модифицированы до сульфоксидов, и в 1979 г. на рынке появился первый из представителей ингибиторов протонного насоса — омепразол, который до настоящего времени эффективно применяется клиницистами для подавления секреции соляной кислоты. Позднее семейство ингибиторов протонного насоса пополнилось другими соединениями, среди которых пантопразол, лансопразол, эзомепразол и рабепразол [70] (рис. 6.4, а). Все используемые в клинике ингибиторы протонного насоса представляют собой 2-пиридилметилсульфонилбензимидазолы, которые
336 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 |
|
различаются природой и положением заместителей, расположенных в пиридиновом и бензольном кольцах (см. рис. 6.4, а). Исключение составляет эзомепразол: в отличие от омепра-зола, который является рацематной смесью двух оптических изомеров (атом серы в молекулах ингибиторов является хираль-ным), эзомепразол представляет собой чистый S-омепразол. Изменение положения и структуры заместителей в молекулах ингибиторов приводит к изменениям в пиридиновом кольце, что сказывается на значении рК азота этого кольца. Все замещенные бензими-дазолы являются слабыми основаниями, т. е., они способны связывать Н+ в кислой среде. Механизм действия ингибиторов на протонный насос независимо от их структуры, одинаков, все они (а вернее, соединения, образующиеся из них в кислой среде) ковалентно связываются с SH-группами а-субъединицы Н,К-АТФазы за счет образования S—S связи.
Действие всех замещенных бензимидазолов на секрецию соляной кислоты включает следующие этапы [70]:
1) всасывание из желудочно-кишечного тракта;
2) концентрирование в секреторных канальцах париетальных клеток;
3) молекулярная перестройка в кислой среде;
4) ковалентное связывание с SH-группами Н,К-АТФазы.
Лекарственные формы ингибиторов протонного насоса покрыты оболочкой, которая устойчива в кислой, но растворима в слабощелочной среде. Они в неповрежденном виде проходят через желудок и начинают всасываться в тонкой кишке. При значениях рН выше рК молекулы замещенных бензимидазолов не имеют заряда и достаточно гидрофобны, поэтому они довольно легко проникают через мембраны клеток. Попав в кровь, замещенные бензимидазолы быстро перераспределяются между различными тканями. Если эти соединения попадают в раствор, значение рН которого ниже рК азота пиридинового кольца, то они протонируются, причем Н+ связывается с атомом азота пиридинового кольца (см. рис. 6.4, а). Связы-
Глава 6. Лечение хронического панкреатита • 337
 вание Н+ делает молекулу положительно заряженной, в силу этого она не может проникать через мембраны. Далее протонированные ингибиторы протонной помпы накапливаются в тех компартментах клеток, которые имеют рН ниже значения рК для данного ингибитора. В клеточных канальцах рН составляет 0,8—1,0, поэтому ингибиторы протонного насоса в первую очередь накапливаются в секреторных канальцах париетальных клеток, причем их концентрация там может в тысячу раз превышать их концентрацию в крови. Концентрирование ингибиторов протонного насоса в секреторных канальцах париетальных клеток является первой стадией, играющей существенную роль в обеспечении избирательности их действия.
вание Н+ делает молекулу положительно заряженной, в силу этого она не может проникать через мембраны. Далее протонированные ингибиторы протонной помпы накапливаются в тех компартментах клеток, которые имеют рН ниже значения рК для данного ингибитора. В клеточных канальцах рН составляет 0,8—1,0, поэтому ингибиторы протонного насоса в первую очередь накапливаются в секреторных канальцах париетальных клеток, причем их концентрация там может в тысячу раз превышать их концентрацию в крови. Концентрирование ингибиторов протонного насоса в секреторных канальцах париетальных клеток является первой стадией, играющей существенную роль в обеспечении избирательности их действия.
Замещенные бензимидазолы являются предшественниками лекарства, т. е. они неактивны в той форме, в которой употребляются. Протонирова-ние приводит к значительным изменениям в структуре соединений, после протонирования происходит превращение относительно стабильной ме-тилсульфенильной группы в высокореактивный циклический сульфена-мид. Сульфенамид образуется в результате переноса Н+ от азота пирими-динового цикла к азоту имидазольного кольца, что увеличивает электро-фильность второго атома углерода имидазола. Вслед за этим происходит нуклеофильная атака непротонированного азота пиридинового цикла на углерод имидазола, вследствие чего между этими атомами образуется кова-лентная связь. В результате между пиридиновым и имидазольным кольцами образуется еще один цикл. Образующийся тетрациклический сульфенамид реагирует с SH-группами Н,К-АТФазы (рис. 6.4, б). Поскольку сульфенамид накапливается главным образом в секреторных канальцах, он будет реагировать только с теми частями молекул белков, которые экспонированы в пространство канальцев. Биохимический анализ показал, что единственным белком, связывающимся с замещенными бензимидазолами в секреторных канальцах париетальных клеток, является а-субъединица Н,К-АТФазы [289J.
Надо отметить, что эзомепразол взаимодействует с Н,К-АТФазой так же, как и омепразол [275]. Поскольку циклизация у R- и S-изомеров проходит одинаково, то из обоих изомеров образуется один и тот же тетрациклический сульфенамид, так как атом серы вследствие циклизации перестает быть хиральным. Различия в действии эзомепразола и омепразола на секрецию соляной кислоты проявляются только за счет различий в скорости метаболизирования их системой цитохрома Р-450 (R- и S-изомеры утилизируются с разной скоростью, это будет рассмотрено ниже).
S—S связь ковалентна, по этой причине замещенные бензимидазолы являются необратимыми ингибиторами протонного насоса. Устранение ингибирования после ковалентного связывания тетрациклического сульфе-намида происходит лишь после того, как молекула протонного насоса элиминируется путем протеолиза. Однако S—S связь может быть восстановлена под действием такого соединения, как глутатион, присутствующего в секреторных канальцах, поэтому время, в течение которого существует за-ингибированная форма протонного насоса, уменьшается, причем скорость восстановления зависит от химической структуры ингибитора. У человека ингибирование секреции устраняется наполовину через 15 ч после начала действия лансопразола, через 30 ч часов после ингибирования секреции омепразолом и рабепразолом и примерно через 46 ч после действия пан-топразола [381].
Изменение структуры и положения заместителей в молекуле замещенных бензимидазолов приводит к изменению скорости их активации в ки-
338 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 |

|
слой среде. При значении рН 1,0, которое характерно для секреторных канальцев, все замещенные бензими-дазолы превращаются в активные соединения достаточно быстро. Однако при рН 5,0 половина времени, необходимого для превращения соединений в активный сульфенамид (t05) для омепразола и лансоп-разола составляет 0,3 ч, для пантопразола — 1,2 ч и для рабепра-зола - 0,01 ч [157]. Это коррелирует со скоростью ингибиро-вания этими соединениями транспорта Н+
везикулярной фракцией, полученной из слизистой оболочки желудка (рис. 6.5). Хотя все ингибиторы в конечном итоге обеспечивают полное ингиби-рование протонного насоса в этих везикулах, время, в течение которого достигается полное ингибирование, различно. Максимально быстро развивается эффект рабепразола (полное ингибирование происходит через 10 мин). Медленнее, и примерно с одинаковой скоростью действуют лансопразол и омепразол (полное ингибирование через 20 мин). Дольше всего развивается эффект пантопразола, даже через 30 мин транспорт ингибиру-ется лишь на 50 % (см. рис. 6.5). Таким образом, лимитирующей стадией в ингибировании является, по-видимому, скорость активации замещенных сульфенамидов, которая тем выше, чем больше значение рК для атома азота пиримидинового цикла. Кроме того, различия в структуре замещенных бензимидазолов приводят к тому, что ингибирование протонного насоса наблюдается при различных концентрациях ингибиторов. Так, полумаксимальный эффект омепразола наблюдается при его концентрации 0,5 мкМ, тогда как полумаксимальный эффект рабепразола — при концентрации 0,07 мкМ [324]. По-видимому, это также обусловлено различиями в скорости активации ингибитора.
Наибольшая скорость наступления антисекреторного эффекта рабепразола в сравнении с другими ингибиторами протонного насоса показана в многочисленных клинических исследованиях [149, 328, 334, 337, 338, 431]. Так, по данным исследований D. Pantoflickova и соавт. [337] в первые сутки приема разовых доз различных ингибиторов протонного насоса достоверно более мощный антисекреторный эффект по данным суточного мо-ниторирования рН отмечен в группе рабепразола (рис. 6.6.). Результаты недавно опубликованного исследования P. Jr. Miner и соавт. [315] с аналогичным дизайном подтверждают полученные данные — время с интрагаст-ральным рН выше 4 на фоне приема 20 мг рабепразола в сутки составило 12,1 ч, омепразола (20 мг/сут) — 11,8 ч, лансопразола (30 мг/сут) — 11,5 ч, пантопразола (40 мг/сут) — 10,1 ч. Следует отметить, что авторы сравнива-
Глава 6. Лечение хронического панкреатита • 339


|
ли антисекреторный эффект различных ингибиторов протонного насоса и с эзомепразолом, эффект которого оказался наибольшим — 14 ч с ин-трагастральным рН выше 4, однако не совсем понятно, в связи с чем авторами была использована двойная доза эзомепразо-ла (40 мг/сут). В то же время, по данным К. Bais-ley и соавт., одинаковая часть времени суток с внутрижелудочным рН выше 4 достигается применением минимальной дозы рабепразола (10 мг/ сут) и стандартной дозы эзомепразола (20 мг/сут) как в первые, так и на 5-е сутки приема препаратов [149]. При сравнении влияния на снижение желудочной секреции рабепразола и эзомепразола, как наиболее эффективных в настоящее время препаратов, в дозе 20 мг/сут было выявлено статистически достоверное отличие, заключавшееся в более высокой эффективности рабепразола как на первый (38,5 против 19,4 %), так и на 5-й день применения (52,8 против 42,5 %) [431].
Таким образом, становится понятно, почему при приеме рабепразола отмечается максимально быстрая редукция клинической симптоматики в сравнении с другими ингибиторами протонной помпы при лечении кисло-тозависимых заболеваний [137, 185].
Установлено, что различные ингибиторы протонного насоса модифицируют разные SH-группы а-субъединицы Н,К-АТФазы: омепразол взаимодействует с 813-м и 822-м остатками цистеина, располагающимися в 5-м и 6-м трансмембранных сегментах, а также с 892-м цистеиновым остатком. Лансопразол, напротив, модифицирует цистеины в положении 321, 813 и 822, пантопразол — цистеиновые остатки 813 и 822, а рабепразол реагирует с последними двумя остатками цистеина, вызывая полное ингибирование протонного насоса, после чего реагирует также с цистеинами, находящимися в положении 321 и 892 [157]. Считалось, что ингибирование лучше всего коррелирует с модификациями 813 и 822 цистеинового остатка, расположенными в 5-м и 6-м трансмембранных сегментах а-субъединицы Н,К-АТФазы, которые формируют канал для катионов. Но данные, полученные с использованием точечного мутагенеза, показывают, что только удаление 822-го остатка цистеина устраняет ингибирование насоса под действием омепразола [276].
По-видимому, связывание ингибитора предотвращает конформацион-ные переходы, необходимые для функционирования канала.
340 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 Итак, все применяемые в настоящее время ингибиторы протонного насоса обеспечивают достаточно эффективное его ингибирование, однако различия в структуре ингибиторов приводят к изменению скорости инги-бирования и концентрации ингибитора, которая обеспечивает максимальный эффект.
Итак, все применяемые в настоящее время ингибиторы протонного насоса обеспечивают достаточно эффективное его ингибирование, однако различия в структуре ингибиторов приводят к изменению скорости инги-бирования и концентрации ингибитора, которая обеспечивает максимальный эффект.
Создатели ингибиторов протонного насоса заботились об обеспечении их селективности, стараясь создать соединение, которое будет действовать быстро и эффективно, но исключительно на протонный насос. Исходя из механизма действия ингибиторов, это можно сделать, синтезировав ингибиторы со значениями рК, которые близки к значениям рН, характерным для секреторных канальцев, и достаточно далеки от рН, которые характерны для других отделов клетки. Предполагалось, что наиболее безопасными окажутся ингибиторы, рК которых ниже 4,0. В то же время от рабепразола, имеющего рК 4,9—5,0, можно было ожидать побочных эффектов [275]. Действительно, в клетке существуют отделы, рН которых, согласно имеющимся литературным данным, достаточно низок для того, чтобы в них ра-бепразол мог превратиться в активную форму. Это в первую очередь лизо-сомы, а также эндосомы, клатриновые везикулы, хромаффинные гранулы, синаптические везикулы, где, как считалось, рН может снижаться до значений 4,8—5,0. Правда, экспериментальное измерение рН внутри лизосом показывает, что значения рН колеблются в диапазоне 5,17—6,44 [224]. Кроме того, считается, что достаточно кислые значения рН характерны для некоторых областей почечных канальцев, остеокластов, обеспечивающих резорбцию кости, а также в макрофагах и метастазах раковых опухолей [333]. Можно было бы предполагать, что в этих местах может произойти превращение рабепразола в активную форму, что приведет к его взаимодействию с Н,К-АТФазой или другими потенциальными мишенями, содержащими SH-группы. Возникает вопрос, что это за мишени?
В первую очередь необходимо сказать, что в настоящее время нет сколько-нибудь убедительных доказательств в пользу того, что рабепразол модифицирует SH-группы каких-либо белков, за исключением Н,К-АТ-Фазы париетальных клеток желудка, вызывая изменение их функциональных характеристик. Единственное сообщение об ином действии рабепразола касается ингибирования переносчика гистамина в энтерохромаффино-подобных (ЭХП) клетках желудка крысы [442]. Этот переносчик функционирует за счет градиента протонов, который создается на мембранах гиста-минсодержащих гранул V-АТФазой [364]. Авторы предположили, что рабепразол ингибирует V-АТФазу. Однако оказалось, что на освобождение гистамина под действием рабепразола не оказывал влияния бафиломицин, ингибитор АТФазы V-типа. При этом спонтанное освобождение гистамина из ЭХП-клеток в этих экспериментах составляло 7 %, рабепразол в концентрации 10° М обеспечивал освобождение 11 % гистамина, а гастрин в концентрации 10~8 М — 24 % гистамина [442]. Итак, под действием рабепразола освобождалось лишь на 4 % больше гистамина, чем при его спонтанном освобождении, причем, по-видимому, рабепразол в этих экспериментах влиял непосредственно на переносчик гистамина. Авторы не сравнили действие рабепразола с действием других ингибиторов протонного насоса, и неясно, вызван ли его ингибирующий эффект молекулярной трансформацией рабепразола в кислой среде. Не исключено, что и другие ингибиторы могут действовать на переносчик гистамина так же, как и рабепразол.
Таким образом, в настоящее время нет экспериментальных данных, позволяющих считать, что рабепразол может обладать существенным побоч-

|
| Глава 6. Лечение хронического панкреатита • 341 |
ным действием. Это хорошо подтверждается многочисленными клиническими данными. Так, совокупный анализ 63 контролируемых исследований, посвященных клинической переносимости и наличию побочных эффектов рабепразола в Японии, Северной Америке и Европе показал хорошую переносимость препарата [262]. Анализ побочных эффектов, возникающих при приеме различных суточных доз рабепразола (10, 20 и 40 мг в сутки) показал сопоставимость частоты побочных эффектов при приеме плацебо и рабепразола [250]. Существуют убедительные данные, полученные в крупном европейском мультицентровом исследовании, когда при приеме одинаковых доз (20 мг/сут) омепразола и рабепразола частота серьезных побочных эффектов достигла 4 % при приеме омепразола и не превысила 1 % при приеме рабепразола [108].
В табл. 6.11 представлены наиболее часто встречающиеся побочные эффекты различных ингибиторов протонной помпы, анализ которых позволяет заключить, что одним из наиболее безопасных препаратов является именно рабепразол.
Итак, рассмотрение свойств ингибиторов протонного насоса париетальных клеток желудка свидетельствует о том, что хотя все ингибиторы протонного насоса способны обеспечить достаточно эффективное ингибиро-вание желудочного кислотообразования, максимально быстро развивающимся эффектом, который наступает при низких концентрациях ингибитора, обладает рабепразол. При этом рабепразол, как и другие ингибиторы, действует необратимо, и хотя S—S связь, образуемая этим ингибитором с Н,К-АТФазой, способна разрушаться под действием глутатиона, присутствующего в канальцах париетальных клеток, для обеспечения ингибирую-щего эффекта рабепразола достаточно принятия лекарства один раз в день. В настоящее время нет убедительных доказательств, что рабепразол в организме человека оказывает значимое действие на иные молекулярные мишени, нежели протонный насос париетальных клеток.
Помимо этого, рабепразол несколько иначе, чем другие ингибиторы протонного насоса, метаболизируется в организме. Как омепразол и эзо-мепразол, рабепразол элиминируется путем окисления главным образом в печени представителями двух изоформ цитохрома Р-450: CYP 2C19 и CYP ЗА4. Но для рабепразола характерно также неферментативное окисление, что снижает долю лекарства, метаболизирующегося через эти изоформы цитохрома Р-450 [398]. В связи с этим по сравнению с омепразолом и лан-сопразолом уменьшается риск взаимодействия рабепразола с другими лекарственными препаратами, метаболизируемыми главным образом через CYP 2C19, например с варфарином, диклофенаком, фенитоином и толбу-тамидом [245].
Таким образом, обзор фармакологических и клинических эффектов свидетельствует, что рабепразол (париет, Janssen Pharmaceutica) характери-
342 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 зуют хорошая клиническая переносимость и минимум побочных эффектов, улучшенный профиль безопасности, в том числе у лиц пожилого возраста, быстрая конвертация в активную форму и значительная выраженность антисекреторного действия [38, 129, 177], что позволило нам применить его для купирования боли у больных ХП [78].
зуют хорошая клиническая переносимость и минимум побочных эффектов, улучшенный профиль безопасности, в том числе у лиц пожилого возраста, быстрая конвертация в активную форму и значительная выраженность антисекреторного действия [38, 129, 177], что позволило нам применить его для купирования боли у больных ХП [78].
В исследование было включено 68 больных с обострением ХП, в том числе 26 мужчин (38,2 %) и 42 женщины (61,8 %) со средним возрастом 54,2 ± 5,6 года. Средняя длительность анамнеза составила 6,5 ± 1,8 года. По этиологическому фактору в структуре обследованных больных было 48,5 % больных алкогольным ХП и 39,7 % — билиарным ХП; у 8,9 % больных — смешанный вариант ХП, а у 2,9 % больных причину развития ХП нам установить не удалось (идиопатический ХП).
Критерии включения в исследование (диагноз считали доказанным и пациент включался в исследование при наличии одного и более признаков из каждой группы критериев):
Анамнестические (регулярное употребление алкоголя и табакокурение и/или доказанная патология желчного пузыря, общего желчного протока, сфинктера Одди).
Клинические и лабораторные (характерный болевой абдоминальный синдром при отсутствии другой причины его возникновения, гиперамила-земия, гиперлипаземия, гипертрипсинемия, гиперамилазурия, эластаза кала не менее 100 мкг/г, стеторея.
Данные лучевых методов диагностики (увеличение размеров поджелудочной железы, дилатация панкреатического протока более 2 мм, неровность контуров и неоднородность паренхимы ПЖ, конкременты или каль-цификация паренхимы ПЖ, повышение эхогенности стенок вирсунгова протока).
Критериями исключения из исследования были: наличие гепатита, цирроза печени любой этиологии в анамнезе, или выявленных впервые; наличие у больного эрозивно-язвенного поражения слизистой оболочки гастро-дуоденальной зоны в момент проведения исследования, холелитиаз, осложненные формы ХП, наличие выраженной внешнесекреторной недостаточности ПЖ (эластаза кала менее 100 мкг/г), резистентность к применяемым ингибиторам протонной помпы.
Всем больным назначалась стандартная терапия — креон из расчета 50 000 Ph.Eur. липолитической активности в сутки и баралгин 5,0 внутримышечно 2 раза в сутки. Все больные были разделены на 3 группы, сопоставимые по полу, возрасту, этиологическому фактору и выраженности болевого абдоминального синдрома; 20 человек получали омепразол 20 мг в сутки, 23 — омепразол 40 мг в сутки (2 приема по 20 мг), 25 больных — рабепразол (париет) 20 мг в сутки (1-я, 2-я и 3-я группы соответственно). В качестве контрольной группы была обследована группа практически здоровых лиц в количестве 18 человек со средним возрастом 46,7 ±4,1 года.
Суточное мониторирование рН желудочного содержимого проводили с помощью портативного ацидогастрометра «Гастроскан-24» («Исток-Система»), автоматически фиксировавшего рН в теле желудка и двенадцатиперстной кишке в течение суток. Контроль установки зонда осуществлялся рентгеноскопически. При первичном обследовании использовалась модифицированная методика пролонгированного (48-часового) рН-монитори-рования, разработанная на нашей кафедре [73]. В первые 24 ч проводилось исследование базального кислотообразования, в последующие 24 ч — фармакологическая проба с препаратом для оценки его антисекреторного эф-
Глава 6. Лечение хронического панкреатита • 343
 фекта [118, 135]. Если по данным фармакологической пробы в теле желудка зафиксирован рН > 4,0 менее 5 ч за сутки, то пациент расценивался как резистентный к данному препарату и исключался из исследования. На 10-е сутки от начала терапии всем больным было проведено контрольное рН-мониториро-вание по стандартной методике (24-часовое) для отсроченной оценки эффективности антисекреторной терапии.
фекта [118, 135]. Если по данным фармакологической пробы в теле желудка зафиксирован рН > 4,0 менее 5 ч за сутки, то пациент расценивался как резистентный к данному препарату и исключался из исследования. На 10-е сутки от начала терапии всем больным было проведено контрольное рН-мониториро-вание по стандартной методике (24-часовое) для отсроченной оценки эффективности антисекреторной терапии.
Критериями оценки антисекреторного эффекта являлись
продолжительность латентного периода (время от момента приема препарата до подъема интрагастрального рН > 4 и продолжительность действия препарата по времени с интрагастральным рН > 4.
Динамика болевого абдоминального синдрома оценивалась по методике субъективной оценки выраженности болевого синдрома по десятибалльной шкале [27]. Показателями эффективности терапии также считались изменение уровня панкреатических ферментов в крови и моче, динамика сывороточных концентраций цитокинов.
Интенсивность болевого абдоминального синдрома до назначения терапии в группах достоверно не отличалась и составляла 6,9 ± 1,8; 7,2 + 2,1 и 7,3 ± 1,5 баллов соответственно. По истечении 1 сут от начала терапии только в 3-й группе отмечено значительное снижение интенсивности болевого абдоминального синдрома —до 5,3 ± 0,6 балла, однако данная тенденция достоверной не оказалась. Начиная со 2-х суток наблюдения и до конца 3-й недели лечения в группе больных, получавших в составе комплексной терапии рабепразол, отмечена достоверно более низкая (р < 0,05) выраженность болевого абдоминального синдрома (рис. 6.7).
К 3-м суткам лечения средняя интенсивность болевого абдоминального синдрома на фоне приема париета снизилась до 3 баллов, что в 2 раза ниже выраженности болей на фоне приема 40 мг омепразола. Как видно из рис. 6.7, к окончанию 1-й недели лечения выраженность болей в группе больных ХП, принимавших париет, была в 4,5 и 3,4 раза меньше по сравнению с 1-й и 2-й группами; а к 10-м суткам лечения —уже в 9,5 и 6,0 раза соответственно, почти на порядок превышая эффективность приема 20 мг омепразола.
Уменьшение интенсивности болевого абдоминального синдрома на фоне комплексной терапии у больных ХП позволило производить также и постепенную отмену баралгина (рис. 6.8). Отмечено, что в 3-й группе болевой абдоминальный синдром был купирован в течение 1-х суток у 3
Дата добавления: 2015-10-21; просмотров: 71 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Фармакотерапия 1 страница | | | Фармакотерапия 3 страница |