
Читайте также:
|
Y. Hori et al. [266] исследовали эффект вакуолизирующего токсина HP на секрецию ферментов в изолированных ацинусах крысы. Авторы выяви-
Глава 2. Этиология и патогенез хронического панкреатита • 37
 ли дозозависимое снижение секреции амилазы при введении вакуолизи-рующего токсина HP.
ли дозозависимое снижение секреции амилазы при введении вакуолизи-рующего токсина HP.
В двух исследованиях [266, 279] изучались эффекты изолированных компонентов бактерии, аммиака и вакуолизирующего токсина HP на ПЖ. Было выявлено стимулирующее влияние HP на панкреатическую секрецию. Известно, что HP ингибирует синтез и выброс желудочными D-клет-ками соматостатина [343, 374, 404], что сопровождается сокращением ан-тральной плотности D-клеток с возвратом их числа к норме после эради-кации HP [404]. Следствием HP-индуцированного ингибирования синтеза и выделения соматостатина является увеличение плотности G-клеток и синтеза гастрина в антральном отделе желудка. Результат всех указанных гормональных изменений — увеличение желудочной кислотной секреции без изменения чувствительности париетальных клеток к гастрину [200, 285, 359, 390].
Известно, что экзокринная панкреатическая секреция ингибируется со-матостатином [185, 251]. Паракринный эффект соматостатина в слизистой оболочке желудка, вряд ли, может влиять на панкреатическую секрецию. Однако, ацидификация двенадцатиперстной кишки может стимулировать панкреатическую секрецию посредством выделения секретина [249]. Кроме того, гастрин проявляет слабый ХК-подобный эффект на панкреатическую секрецию [447]. В недавнем исследовании [184], выполненном на группе из 19 здоровых добровольцев (11 HP-позитивных), было определено, что и HP-позитивные, и HP-негативные субъекты имели нормальную циклическую межпищеварительную панкреатическую секрецию, скоординированную с гастроинтестинальной моторикой. Межпищеварительное постпрандиальное выделение ПП и мотилина не соотносилось с наличием HP-инфекции, в то время как постпрандиальная и межпищеварительная секреция гастрина была выше у HP-позитивных больных. Межпищеварительная панкреатическая секреция амилазы, липазы и химотрипсина была достоверно выше у HP-позитивных лиц, в то время как постпрандиальная панкреатическая секреция ферментов имела лишь тенденцию к повышению.
Гипергастринемия с ХК-подобными эффектами и альтернативное за-кисление двенадцатиперстной кишки [249] посредством гиперсекреции секретина могли способствовать межпищеварительной панкреатической гиперсекреции, в то время как оба фактора играли менее важную физиологическую роль в постпрандиальной стимуляции ПЖ.
Исследование J. E. Dominguez-Munoz и P. Malfertheiner [184] также подтверждает предположение, что HP-инфекция у лиц с бессимптомным носительством связана с изменениями не только в физиологии желудочной секреции, но также и в секреции ПЖ, и что эта связь между ПЖ и HP теоретически может иметь патофизиологическое значение при заболеваниях pancreas.
Helicobacter pylori и ХП. Существуют различные гипотезы о взаимодействии между HP и ПЖ у больных ХП. Первая — возможная роль HP в патогенезе и прогрессировании ХП, по крайней мере его идиопатических форм; вторая — влияние HP-инфекции на экзокринную панкреатическую секрецию у больных ХП с нарушением последней; третья — влияние самого ХП на гастроинтестинальную физиологию и потенцирование колонизации HP слизистой оболочки желудка [331].
Предположительная роль HP в патогенезе ХП высказана после исследований, показавших повреждение HP печеночной ткани в экспериментальных моделях на животных [214]. Недавние данные от J. G. Fox и соавт.
38 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 [215] также демонстрируют присутствие одной из разновидностей рода Helicobacter в желчи и тканях желчного пузыря больных хроническим холециститом. Н. J. Monstein и соавт. идентифицировали HP в желчных камнях у больных хроническим калькулезным холециститом [350], который, как мы сообщали ранее, является одной из причин развития билиарноза-висимого ХП. В недавнем отечественном исследовании HP был выявлен в конкрементах желчного пузыря у 18,8 % больных [57].
[215] также демонстрируют присутствие одной из разновидностей рода Helicobacter в желчи и тканях желчного пузыря больных хроническим холециститом. Н. J. Monstein и соавт. идентифицировали HP в желчных камнях у больных хроническим калькулезным холециститом [350], который, как мы сообщали ранее, является одной из причин развития билиарноза-висимого ХП. В недавнем отечественном исследовании HP был выявлен в конкрементах желчного пузыря у 18,8 % больных [57].
Приблизительно 10—30 % случаев панкреатитов могут быть определены как идиопатический ХП. Может ли данная бактериальная инфекция быть причиной по крайней мере части этих случаев, остается вопросом.
В одном из последних исследований, проведенном в Италии [178], было оценено наличие ДНК-последовательности HP при помощи полимеразной цепной реакции в панкреатическом соке 40 пациентов с алкогольным ХП, инфицированных HP. В то время как все биопсии из желудка были НР-позитивные, ни в одном из случаев не было выявлено ДНК-последовательности HP в панкреатическом секрете. Авторы заключили, что антибактериальная активность панкреатического сока препятствует колонизации HP в ПЖ. Это исследование, однако, не изучало ДНК-последовательности других разновидностей рода Helicobacter и не дало определенного ответа на вопрос относительно того, может ли Helicobacter играть роль в патогенезе ХП в целом.
Следует отметить, что G. Manes и соавт. у 40 больных ХП продемонстрировали отсутствие различий внешнесекреторной функции pancreas при всех морфологических стадиях болезни (по данным ЭРХПГ) между инфицированными и неинфицированными HP пациентами. Только тяжесть заболевания коррелировала с ухудшением функции pancreas у обследованных больных [332].
Интересны результаты исследований Л. А. Холоимовой и соавт., обследовавших 47 детей с хроническим дуоденитом и язвенной болезнью двенадцатиперстной кишки, ассоциированными с HP. Авторами отмечается, что в 98 % случаев имели место ультразвуковые признаки ХП (неоднородность паренхимы, диффузное повышение эхогенности ПЖ, нечеткость и неровность контуров железы), а в 91 % случаев имелись признаки внешнесекреторной недостаточности ПЖ (по данным микроскопии кала). При этом выраженность выявленных изменений морфологии и функции ПЖ не коррелировала со степенью воспалительных изменений слизистой оболочки двенадцатиперстной кишки [75].
По результатам исследований Л. Н. Малямовой (2003), несмотря на частую встречаемость ультразвуковых признаков ХП у детей с воспалительными и эрозивно-язвенными поражениями, ассоциированными с HP (62,7—73,8 %), признаки внешнесекреторной недостаточности ПЖ (стеа-торея) встречались достаточно редко [48]. Полученные данные далеко не однозначны, поскольку, во-первых, не совсем ясно, что явилось причиной изменений ПЖ — непосредственно HP, либо воспалительно-некротический процесс в двенадцатиперстной кишке, либо же совокупное воздействие этих и других факторов. Во-вторых, отсутствие признаков внешнесекреторной недостаточности ПЖ у детей, в большинстве случаев с коротким анамнезом заболевания, мало о чем говорит, поскольку возникновению экзокринной недостаточности ПЖ чаще предшествует длительный анамнез ХП.
Некоторые исследователи определили увеличение как базальной, так и стимулированной желудочной кислотной секреции у HP-позитивных пациентов с ХП [397, 432], другие — гиперацидность в желудке посредством
Глава 2. Этиология и патогенез хронического панкреатита • 39
 суточного мониторирования рН у больных ХП с внешнесекреторной недостаточностью ПЖ [123, 380]. Однако существуют данные и об уменьшении постпрандиальной секреции кислоты с гипергастринемией у больных ХП [409]. Следует отметить, что все эти исследования не учитывали эндоскопические и гистологические особенности слизистой оболочки желудка, знание которых могло бы помочь в интерпретации противоречивых данных. Изменения функции желудка, описанные у больных ХП, скорее могли отражать присутствие HP-инфекции в его слизистой оболочке, чем изменения, вызванные патологией ПЖ.
суточного мониторирования рН у больных ХП с внешнесекреторной недостаточностью ПЖ [123, 380]. Однако существуют данные и об уменьшении постпрандиальной секреции кислоты с гипергастринемией у больных ХП [409]. Следует отметить, что все эти исследования не учитывали эндоскопические и гистологические особенности слизистой оболочки желудка, знание которых могло бы помочь в интерпретации противоречивых данных. Изменения функции желудка, описанные у больных ХП, скорее могли отражать присутствие HP-инфекции в его слизистой оболочке, чем изменения, вызванные патологией ПЖ.
G. Manes и соавт. [332] недавно изучили 40 пациентов с алкогольным ХП в сравнении с 40 здоровыми лицами и 40 больными с алкогольным циррозом печени без ХП с целью оценки распространенности НР-инфек-ции и характеристики слизистой оболочки желудка. Группа с алкогольным циррозом печени была специально введена для оценки потенциального риска токсического эффекта алкоголя на слизистую оболочку желудка. Авторами было определено, что распространенность HP-инфекции у больных ХП равна таковой у пациентов с алкогольным циррозом печени и у здоровых лиц (38 % при ХП, 30 % при циррозе печени и 28 % — у здоровых бессимптомных носителей). Авторы не нашли никаких различий активности и выраженности HP-ассоциированного гастрита. Наоборот, выраженность HP-негативного хронического гастрита в антральном отделе была достоверно выше у больных ХП по сравнению с группой больных циррозом печени и здоровыми HP-носителями. Это наблюдение приводит нас к гипотезе, что помимо алкоголя существуют другие факторы, вероятно, связанные с ХП, и потенцирующие развитие хронического НР-нега-тивного гастрита у больных ХП.
В то же время, по данным Н. Б. Губергриц и И. Н. Остроуховой, частота обсемененности Helicobacter pylori у больных ХП составляет 86,5 %, причем у всех больных отмечены воспалительные или эрозивно-язвенные поражения гастродуоденальной зоны [14]. Конечно, существует вероятность, что данный факт связан с высокой инфицированностью HP в популяции России и Украины [27].
В этой связи нам хотелось бы обратиться к результатам другого исследования [362], в котором изучалась распространенность HP-инфекции у больных ХП с дуоденальными язвами и без таковых по сравнению с группой контроля, включавшей больных дуоденальной язвой без ХП. В этом исследовании 27 % больных ХП имели язву двенадцатиперстной кишки. Распространенность антител против HP (IgG) составила 22 % у больных ХП без язвы и 60 % в группе больных с сочетанной язвой двенадцатиперстной кишки и ХП. Для сравнения 86 % больных контрольной группы с дуоденальными язвами были инфицированы HP. Этот факт свидетельствует, что HP все-таки имеет какое-то значение в развитии дуоденальных язв у больных ХП, однако HP, скорее всего, это не единственная причина. Определенное патогенетическое значение здесь могут иметь нарушения микроциркуляции в слизистой оболочке желудка, изменения биохимии желчи и др.
Helicobacter pylori и ОП. Возможная роль HP в развитии ОП до сих пор не изучена. В целом HP вряд ли является непосредственной причиной ОП, даже при так называемом идиопатическом ОП, однако нельзя полностью исключить влияния HP на развитие болезни. Усиленная стимуляция ПЖ в результате гипергастринемии или дуоденальной ацидификации, так же как перемещение HP или его токсинов из гастродуоденальной слизистой оболочки в ПЖ, являются потенциальными механизмами, объясняющими
40 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 возможное влияние HP на развитие ОП [331]. Z. Warzecha и соавт. изучали эффект HP-инфекции слизистой оболочки желудка на модели ишемиче-ского ОП. При наличии HP-инфекции было отмечено существенное сокращение притока крови и усиление ишемического повреждения в ПЖ после реперфузии. Плазменные уровни амилазы, липазы, так же как IL-ip и IL-10, были достоверно выше у инфицированных животных. Авторы интерпретировали эти данные как свидетельство негативного эффекта НР-инфекции в желудке на течение ОП. Это могло быть связано и с выделением бактериями липополисахаридов, что приводило к активации лейкоцитов и усилению местной и общей воспалительной реакции [501].
возможное влияние HP на развитие ОП [331]. Z. Warzecha и соавт. изучали эффект HP-инфекции слизистой оболочки желудка на модели ишемиче-ского ОП. При наличии HP-инфекции было отмечено существенное сокращение притока крови и усиление ишемического повреждения в ПЖ после реперфузии. Плазменные уровни амилазы, липазы, так же как IL-ip и IL-10, были достоверно выше у инфицированных животных. Авторы интерпретировали эти данные как свидетельство негативного эффекта НР-инфекции в желудке на течение ОП. Это могло быть связано и с выделением бактериями липополисахаридов, что приводило к активации лейкоцитов и усилению местной и общей воспалительной реакции [501].
С практической и клинической точек зрения, данные о взаимосвязи HP и панкреатита все еще недостаточны, чтобы подтвердить факт негативного влияния HP на течение заболеваний ПЖ. Однако нельзя не учитывать результаты клинических исследований, доказавших усугубление клиники ХП у больных, инфицированных HP, и определенный результат антихелико-бактерной терапии [13, 29, 362]. Так, по нашим данным, введение эради-кационной терапии в комплексную схему лечения обострения ХП у больных, инфицированных HP, приводило к достоверно более быстрому купированию болевого абдоминального синдрома и уменьшало средние сроки пребывания больного в стационаре. При динамическом наблюдении отмечен противорецидивный эффект эрадикационной терапии в отношении целого ряда случаев ХП [29].
В заключение следует отметить, что к настоящему моменту теоретически обоснована взаимосвязь HP-инфекции с заболеваниями ПЖ. Единичные эпидемиологические исследования не позволяют к настоящему моменту однозначно оценить масштаб данной взаимосвязи в различных регионах мира. Результаты проведенных в России клинических исследований, показавшие ранние и поздние эффекты тройной антихеликобактер-ной терапии у больных ХП, весьма обнадеживают, но требуют дальнейших исследований в этой области, пролонгированного мониторинга за обследованными больными [38].
2.2.3. Наследственный панкреатит
2.2.3.1. Наследственный панкреатит
с аутосомно-доминантным типом наследования
Наследственный панкреатит (НП) с аутосомно-доминантным типом наследования впервые был описан М. V. Comfort и A. G. Streinberg в 1952 г. [159]. В дальнейшем было определено, что НП представляет собой патологию, с одинаковой частотой встречающуюся у лиц обоего пола [44, 387] и не имеющую расовой вариабельности. Он наиболее распространен в Северной Европе, его частота составляет 1—3 % из всех случаев ХП, однако данные о встречаемости НП постоянно увеличиваются в связи с усовершенствованием методов диагностики [388]. Так, частота НП за последние три десятилетия возросла более чем в 4 раза; по последним данным, его доля составляет около 5 % из всех этиологических форм панкреатитов [505].
С середины 1990-х годов несколько независимых групп начали использование революционных технологий молекулярной генетики для генетических исследований в области НП. Итоговым результатом явилось обнаружение D. Whitcomb и L. Bodic в 1996 г. мутации в 3-м экзоне гена катио-
 Глава 2. Этиология и патогенез хронического панкреатита • 41
Глава 2. Этиология и патогенез хронического панкреатита • 41

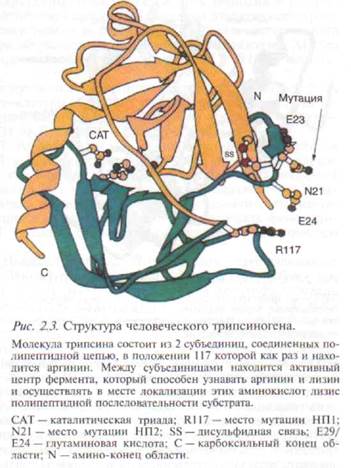
 нического трипсиногена (PRSSl-гене) длинного.плеча 7-й хромосомы (7q35) [316, 504, 505]. Было установлено, что транзиция гуанина на аденин с изменением кодонов (CGC -> САС) приводит к замене аргинина на гистидин в положении 117 (Rl 17H) аминокислотной последовательности фермента (рис. 2.1). Вторая мутация в PRSSl-гене была впоследствии обнаружена во 2-м экзоне —N211 [234]. Эти две мутации (R117H и N211) к настоящему времени идентифицированы в семействах с НП во многих странах, включая Францию [210], Германию [464], Великобританию [168], Японию [365, 367] и США [234, 505].
нического трипсиногена (PRSSl-гене) длинного.плеча 7-й хромосомы (7q35) [316, 504, 505]. Было установлено, что транзиция гуанина на аденин с изменением кодонов (CGC -> САС) приводит к замене аргинина на гистидин в положении 117 (Rl 17H) аминокислотной последовательности фермента (рис. 2.1). Вторая мутация в PRSSl-гене была впоследствии обнаружена во 2-м экзоне —N211 [234]. Эти две мутации (R117H и N211) к настоящему времени идентифицированы в семействах с НП во многих странах, включая Францию [210], Германию [464], Великобританию [168], Японию [365, 367] и США [234, 505].
Таким образом, к 1996 г. наследственным панкреатитом (inherited pancreatitis, hereditary pancreatitis) стало принято называть патологию ПЖ, наследуемую по аутосомно-доминантному типу с неполной пенетрантностью (80 %), морфологическим субстратом которой является воспаление ПЖ; клинически характеризующуюся повторными эпизодами ОП в виде болевого абдоминального и диспепсического синдромов, постепенно увеличивающейся частотой и выраженностью рецидивов, нарастанием степени функциональной (экзокринной и/или эндокринной) недостаточности, отягощенным семейным анамнезом, высоким риском рака ПЖ [44, 264, 286, 393].
Несмотря на то что НП впервые описан в 1952 г., этиология и патогенез НП до конца не изучены. С 1996 г., безусловно, доминирующей стала теория патогенеза, связывающая развитие НП с наследованием мутации гена катионического трипсиногена R117H. Эта мутация становится причиной устойчивости трипсиногена к гидролизу, неконтролируемой каскадной самоактивации трипсина с последующей активацией трипсином других панкреатических проферментов и аутолизом ткани ПЖ.
 В условиях здоровой ПЖ фракция трипсиногена аутоактивируется в трипсин (рис. 2.2). Выявленная транзиция принципиально меняет всю систему регуляции интрапанкреатической активации зимогенов. Известно,
В условиях здоровой ПЖ фракция трипсиногена аутоактивируется в трипсин (рис. 2.2). Выявленная транзиция принципиально меняет всю систему регуляции интрапанкреатической активации зимогенов. Известно,



 42 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
42 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ





 что синтезируемый в ацинусах трипсиноген способен аутоактивизировать-ся трипсином, и этот процесс протекает в незначительных количествах в ткани ПЖ, обеспечивая образование так называемого «запального» трипсина в панкреатическом секрете, вызывающего инициацию процессов пищеварения в двенадцатиперстной кишке при самых начальных этапах поступления панкреатического секрета в просвет последней. Помимо аутоак-тивации трипсиногена, трипсин, являясь эндопептидазой, способен активизировать и все остальные панкреатические проферменты, переводя их в активные энзимы. В норме все проферменты активируются трипсином только в двенадцатиперстной кишке после того, как там под действием другой эндопептидазы — энтерокиназы кишечной каемки энтероцитов — произойдет активация достаточного количества трипсиногена.
что синтезируемый в ацинусах трипсиноген способен аутоактивизировать-ся трипсином, и этот процесс протекает в незначительных количествах в ткани ПЖ, обеспечивая образование так называемого «запального» трипсина в панкреатическом секрете, вызывающего инициацию процессов пищеварения в двенадцатиперстной кишке при самых начальных этапах поступления панкреатического секрета в просвет последней. Помимо аутоак-тивации трипсиногена, трипсин, являясь эндопептидазой, способен активизировать и все остальные панкреатические проферменты, переводя их в активные энзимы. В норме все проферменты активируются трипсином только в двенадцатиперстной кишке после того, как там под действием другой эндопептидазы — энтерокиназы кишечной каемки энтероцитов — произойдет активация достаточного количества трипсиногена.
Таким образом, трипсиноген в физиологических условиях способен в незначительных количествах аутоактивироваться в ткани ПЖ и в основной
Глава 2. Этиология и патогенез хронического панкреатита • 43
 своей массе — энтеро-киназой в кишечнике, запуская в дальнейшем каскад активации остальных панкреатических ферментов.
своей массе — энтеро-киназой в кишечнике, запуская в дальнейшем каскад активации остальных панкреатических ферментов.
Существуют многочисленные дублирующие механизмы, препятствующие преждевременной активации трипсиногена и других проэнзимов в тканях ПЖ и ауто-лизу последней. К ним относятся [421]:
1) образование
ферментов ПЖ в био
химически неактив
ных формах;
2) разделение в
пространстве процес
сов образования и ак
тивации ферментов в
двенадцатиперстной
кишке под действием
энтерокиназы;
3) локализация
ферментов в зимоген-
ных гранулах ацино-
цитов, предотвращаю
щих выход последних
в цитоплазму;
4) низкая концен
трация в цитоплазме ациноцитов ионов кальция, обеспечивающая ста
бильность трипсина в активной форме;
5) секреция панкреатического ингибитора трипсина (ПИТ);
6) способность ферментов ПЖ к аутолизу;
7) продукция а,-антитрипсина и (32-микроглобулина в печени, связы
вающих активированные панкреатические ферменты в крови или перито-
неальной жидкости.
Молекула трипсина состоит из 2 субъединиц, соединенных полипептидной цепью, в положении 117 которой как раз и находится аргинин (рис. 2.3). Между субъединицами находится активный центр фермента, который способен узнавать аргинин и лизин и осуществлять в месте локализации этих аминокислот лизис полипептидной последовательности субстрата. Именно поэтому трипсин и трипсиноподобные ферменты (мезо-трипсин и энзим Y) способны инактивировать интрапанкреатические трипсиноген и трипсин, разрушая в положении аргинин-117 полипептидную цепь последних и обеспечивая до 80 % их инактивации [422].
Одним из основных механизмов, препятствующих в норме повреждению ПЖ, является панкреатический секреторный ингибитор трипсина (ПИТ) (рис. 2.4). ПИТ представляет собой специфический субстрат для
44 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
 трипсина, необратимо
трипсина, необратимо
связывающий серии
фермента с лизином
своего активного цен
тра и тем самым бло
кирующий порядка
20 % общего пула ак
тивированного трип
сина в ткани ПЖ. Ко
личество синтезируе
мого ПИТ по отноше
нию к трипсиногену
составляет приблизи
тельно 1:20. Когда
уровень активности
трипсина низкий,
ПИТ, за счет ингиби-рования трипсина, предотвращает его последующую аутоакти-вацию и активацию других проэнзимов, однако количество трипсиногена значительно больше, чем
ПИТ. Поэтому в период интенсивной активации трипсиногена ПИТ не может выполнять свою защитную роль. В этих обстоятельствах трипсин и трипсиноподобные ферменты, как было сказано ранее, возвращаются в цепь гидролиза, объединяющую две шаровидные области трипсина в R117, что вызывает длительную инактивацию трипсина и остановку каскада [207]. При мутации R117 и замене аргинина на гистидин в положении 117 трипсин и трипсиноподобные ферменты оказываются неспособными ли-зировать молекулы трипсиногена и трипсина, делая единственно возможным механизмом инактивации — ПИТ. У больных НП ПИТ продолжает функционировать в обычном режиме, однако мощности блокирующего эффекта ПИТ оказывается явно недостаточно и при воздействии какого-либо провоцирующего фактора (например, алкоголя) может произойти чрезмерная активация трипсиногена в трипсин, который не может быть инактивирован. Продолжается каскадная неконтролируемая активация панкреатических ферментов и аутодеструкция ПЖ, что в клиническом плане проявляется симптомокомплексом обострения ХП [44]. При этом для развития обострения НП достаточно, чтобы около 50 % молекул трипсиногена и трипсина были устойчивы к гидролизу [147]. Следует отметить, что при обследовании 21 пациента с хроническим алкогольным панкреатитом не было выявлено ни одного случая наличия мутаций R122H (R117H) или N291 (N211) [465].
Механизм, посредством которого мутация N211 приводит к развитию НП, не совсем ясен. Предполагается, что мутация N211 способствует ауто-активации трипсиногена, нарушая взаимодействие с ПИТ [234], либо препятствует инактивации трипсина, изменяя доступность начального участка гидролиза трипсина [143].
Высказывается предположение, что обе общих мутации, R117H и N211, не являются непосредственной причиной НП, а просто служат маркерами
Глава 2. Этиология и патогенез хронического панкреатита • 45
 множества связанных панкреатогенных дефектов, хотя авторами и признается тот факт, что несоответствующее предотвращение дезактивации трипсина в пределах ПЖ ответственно за развитие НП в большинстве случаев [143]. В то же время при обследовании более чем 800 пациентов с ХП без семейного анамнеза было выявлено, что мутации N291 и R122H встречаются очень редко [290].
множества связанных панкреатогенных дефектов, хотя авторами и признается тот факт, что несоответствующее предотвращение дезактивации трипсина в пределах ПЖ ответственно за развитие НП в большинстве случаев [143]. В то же время при обследовании более чем 800 пациентов с ХП без семейного анамнеза было выявлено, что мутации N291 и R122H встречаются очень редко [290].
Начиная с открытия мутации гена катионического трипсиногена, была предложена новая номенклатурная система для человеческих мутаций генома. Согласно последней была произведена замена терминов вышеуказанных мутаций с R117H на R122H и с N211 на N291 [91].
В исследованиях S. Т. Amann и L. К. Gates (2001) изучались экспрессия и пенетрация гена НП у монозиготных близнецов. Полученные данные свидетельствуют о том, что факторы окружающей среды вносят значимый вклад в степень пенетрации НП и, соответственно, в выраженность симптоматики и возраст начала заболевания. Становится понятно, что изучение механизма пенетрации в будущем поможет предотвращать фенотипи-ческое выражение НП у людей с генетической предрасположенностью [87].
 В Великобритании (Ньюкасл) наблюдаются пациенты, принадлежащие к 13 семействам с НП. Данные относительно 9 из этих семейств были ранее опубликованы [168]. R122H (R117H) мутация была идентифицирована в 3 семействах, а мутация N291 (N211) демонстрировалась в 5. В контрольной группе не выявлено ни одной из вышеуказанных мутаций в любом из пяти экзонов гена PRSS1. Авторами было произведено сравнение различных характеристик между группами с различными мутациями. Средний возраст манифестации НП был более высоким в R122H группе (8,4 против 6,5 года, р = 0,007), большее количество пациентов с R122H-MyTa4Heft характеризовалось развернутой клинической картиной к 20-летнему возрасту (89 % против 64 %). Большее количество пациентов с R122H мутацией требовало хирургического вмешательства (8 из 12 против 4 из 17, р = 0,029), причем оперативное пособие в этой группе было выполнено в более раннем возрасте. Отмечена также тенденция у большинства пациентов с мутацией R122H к развитию экзокринной недостаточности ПЖ, однако тяжесть диабета и возраст его манифестации в обеих группах достоверно не различались. В обеих группах алкоголь одинаково провоцировал обострение заболевания. Эти наблюдения были также отмечены при первоначальном описании мутации N211 в 1997 г. [234] и также были отмечены в European Registry of Hereditary Pancreatitis and Pancreatic Cancer (EUROPAC) [267]. Данные о том, что у пациентов с мутацией R122H заболевание манифестирует в более раннем возрасте и чаще возникает необходимость в хирургическом лечении, встречаются и в других источниках [436].
В Великобритании (Ньюкасл) наблюдаются пациенты, принадлежащие к 13 семействам с НП. Данные относительно 9 из этих семейств были ранее опубликованы [168]. R122H (R117H) мутация была идентифицирована в 3 семействах, а мутация N291 (N211) демонстрировалась в 5. В контрольной группе не выявлено ни одной из вышеуказанных мутаций в любом из пяти экзонов гена PRSS1. Авторами было произведено сравнение различных характеристик между группами с различными мутациями. Средний возраст манифестации НП был более высоким в R122H группе (8,4 против 6,5 года, р = 0,007), большее количество пациентов с R122H-MyTa4Heft характеризовалось развернутой клинической картиной к 20-летнему возрасту (89 % против 64 %). Большее количество пациентов с R122H мутацией требовало хирургического вмешательства (8 из 12 против 4 из 17, р = 0,029), причем оперативное пособие в этой группе было выполнено в более раннем возрасте. Отмечена также тенденция у большинства пациентов с мутацией R122H к развитию экзокринной недостаточности ПЖ, однако тяжесть диабета и возраст его манифестации в обеих группах достоверно не различались. В обеих группах алкоголь одинаково провоцировал обострение заболевания. Эти наблюдения были также отмечены при первоначальном описании мутации N211 в 1997 г. [234] и также были отмечены в European Registry of Hereditary Pancreatitis and Pancreatic Cancer (EUROPAC) [267]. Данные о том, что у пациентов с мутацией R122H заболевание манифестирует в более раннем возрасте и чаще возникает необходимость в хирургическом лечении, встречаются и в других источниках [436].
В то же время, по результатам исследований V. Keim и соавт., проводивших обследование членов 30 семей больных ХП неясной этиологии (всего 550 человек), получены несколько другие данные. Так, в 6 семьях (25 человек) были выявлены мутации N291, а в 21 семье (76 человек) — мутации R122H, при этом большинство обследованных больных имели бессимптомное, либо умеренно выраженное течение — 26 и 42 % обследованных лиц соответственно. Тяжесть ХП и время манифестации клинической симптоматики заболевания не зависели от вида конкретной мутации [289]. P. Matew и соавт. показали, что в пределах семейства с НП болезнь развивается у лиц, имеющих более низкие уровни витамина Е и селена в сыворотке крови, и высокий уровень активности супероксидмутазы [337].
| 46 • ХРОНИЧЕСКИЙ ПАНКРЕАТИТ |
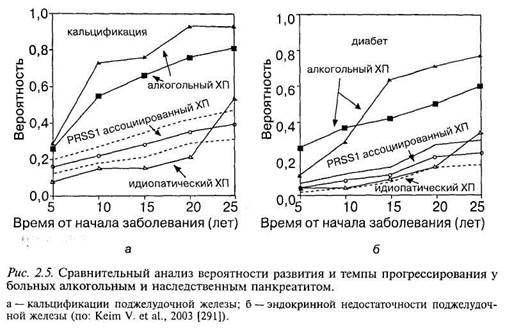
НП характеризуется ранним началом, часто поздним установлением диагноза, образованием кальцификатов, развитием экзокринной и эндокринной недостаточности, частым образованием псевдокист, развитием тромбозов воротной, селезеночной и нижней полой вен, геморрагии. Через 8— 10 лет у 20 % больных присоединяется сахарный диабет, у 15—20 % — выраженная стеаторея [329, 383]. Однако есть данные, опубликованные в 2003 г., показывающие, что темпы прогрессирования ХП, в том числе кальцификация, фиброз ПЖ и эндокринная недостаточность, быстрее и чаще развиваются у лиц с алкогольным ХП без наличия мутаций гена ка-тионического трипсиногена, чем у больных НП [291] (рис. 2.5).
Выявленная зависимость может быть объяснена следующими положениями. Начальные признаки ХП более тщательно регистрируются у детей и подростков, страдающих НП, чем у больных алкогольным ХП, которые регулярно выпадают из поля зрения врачей, продолжая злоупотреблять алкоголем, и обращаются за медицинской помощью от случая к случаю только по поводу рецидивирующей абдоминальной боли. Зачастую впервые признаки алкогольного ХП регистрируются только при первичном обращении в стационар, что не всегда характеризует время начала болезни. Кроме того, прогрессирование заболевания с развитием эндокринной недостаточности может быть ускорено, поскольку более чем 50 % пациентов с алкогольным ХП продолжают злоупотреблять алкоголем после установления диагноза. Известно, что главным образом эндокринная ткань ПЖ чувствительна к воздействию алкоголя и при длительном периоде воздержания от приема алкоголя происходит некоторое восстановление секреторной способности ПЖ в отношении инсулина [245, 309]. Наконец, большинство лиц, злоупотребляющих алкоголем, являются курильщиками, что, как нами было показано ранее, также оказывает негативное воздействие на ПЖ, потенцируя развитие и прогрессирование ХП [272, 321]. С учетом совокупности проанализированных данных становится понятно, почему ав-
Глава 2. Этиология и патогенез хронического панкреатита • 47

торами отмечена подобная зависимость, и алкогольный ХП, действительно, может протекать тяжелее, чем НП.
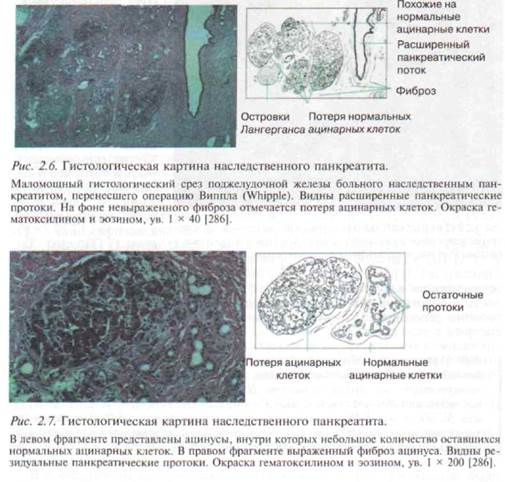
При гистологическом исследовании наблюдаются патологические изменения, типичные и для других этиологических форм ХП [286, 448]. Типичными являются расширение панкреатических протоков, на фоне невыраженного фиброза отмечается атрофия ацинарных клеток, на поздней стадии заболевания возможна потеря островков Лангерганса (рис. 2.6, 2.7), в подавляющем большинстве случаев выявляются панкреатолитиаз и каль-цификация ПЖ [159, 505] (рис. 2.8).
Заподозрить наследственную форму панкреатита позволяют отсутствие этиологических факторов и случаи панкреатита в семье у родственников больного. Действительно, у больных ХП без семейного анамнеза мутации N291 и R122H встречаются крайне редко [290]. Это является принципиальным для установления диагноза так называемого идиопатического ХП у пациентов без надежного семейного анамнеза [167], о чем будет сказано ниже.
Дата добавления: 2015-10-21; просмотров: 80 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Основные этиологические формы панкреатитов 1 страница | | | Основные этиологические формы панкреатитов 3 страница |