
Читайте также:
|
1. Диссоциация кислот. В водном растворе карбоновые кислоты диссоциируют:
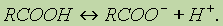
Однако это равновесие диссоциации сильно сдвинуто влево, поэтому карбоновые кислоты, как правило, слабые кислоты.
Вследствие взаимного влияния атомов в молекулах дикарбоновых кислот они являются более сильными, чем одноосновные.
2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот: реагируют с активными металлами, основными оксидами, основаниями:
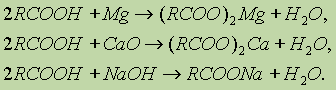
3. Образование функциональных производных. Для карбоновых кислот характерны реакции замещения гидроксильной группы в  с образованием функциональных производных кислот, имеющие общую формулу R—СО—X; здесь R означает алкильную, арильную, амино- группы, группы галогенов.
с образованием функциональных производных кислот, имеющие общую формулу R—СО—X; здесь R означает алкильную, арильную, амино- группы, группы галогенов.
 а)Хлорангидриды получают действием хлорида фосфора (V) на кислоты:
а)Хлорангидриды получают действием хлорида фосфора (V) на кислоты:
б) Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты - реакция этерификации:
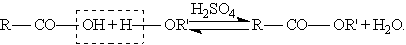
в) Реакции хлорангидридов карбоновых кислот с аммиаком приводят к образованию амидов:
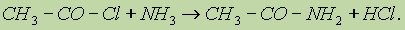
4. Окислительно-восстановительные реакции карбоновых кислот.
Карбоновые кислоты при действии восстановителей способны превращаться в альдегиды или спирты:

Муравьиная кислота — сильный восстановитель и легко окисляется до СО2. Она дает реакцию “серебряного зеркала”:
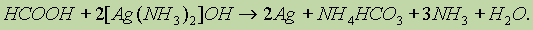
Кроме того, муравьиная кислота окисляется хлором:
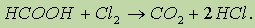
Дата добавления: 2015-10-21; просмотров: 113 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Альдегиды и кетоны. РЕакция присоединения. | | | Аминоспирты. Основные представители, их производные и биороль. |