
Читайте также:
|
Последняя выделяется под яремной веной из того же доступа без мобилизации бифуркации. Использование ОСА проксимальнее бифуркации для проксимального анастомоза направлено на то, чтобы исключить пережатие артерии в сегменте, где высока вероятность присутствия атероматозных изменений (даже без выраженного стеноза) и снизить риск возможной эмболиза-ции мозга через систему ВСА. После системной гепаринизации ПА пережимается в III сегменте, продольно вскрывается ее просвет и накладывается дистальный анастомоз непрерывным обвивным швом нитью пролен 7-0 или 8-0 по типу конец в бок между реверсированной аутовеной и ПА. По завершении анастомоза вена пережимается несколько проксимальнее вновь сформированного соустья и восстанавливается кровоток по ПА. Шунт проводится под яремной веной к ОСА, последняя пережимается, по задней стенке артерии выкраивается эллипсовидное окно, куда непрерывным обвивным швом нитью пролен 5-0 или 6-0 по типу конец в бок вшивается аутовена. После пуска кровотока по шунту ПА дотируется или клипируется сразу ниже дистального анастомоза (в своем более проксимальном сегменте).
У больных молодого возраста (до 35 лет) при окклюзии контралате-ральной ВСА и не пригодных в качестве трансплантата периферических венах возможно использование в качестве артериального кондуита гомолатеральной НСА. Последнюю скелетизируют на необходимом протяжении, перекидывают над ВСА и анастомозируют с ПА в III сегменте, как описано выше. Если на уровне формирования анастомоза диаметр НСА уже недостаточен, то возможно вшить реверсированную аутовенозную вставку (если доступен для трансплантации хотя бы какой-нибудь сегмент вены) между стволом НСА в участ-
ке, имеющем нормальный диаметр, и ПА. При крупном размере затылочной артерии в указанной ситуации возможно формирование анастомоза между a.occipitalis и ПА.
При невозможности использовать и аутовену, и систему НСА для реваскуляризации ПА применяют методику резекции последней в III сегменте и реплантации ее дисталь-ной порции по типу конец в бок в ВСА на этом уровне. Возможность выполнения такого типа операции в значительной мере зависит от анатомических соотношений сосудов в указанной области и данная методика неприменима у больных, не толерирующих пережатие ВСА.
Результаты реконструкций ПА можно оценивать в целом как достаточно хорошие. Эти операции, как правило, не сопровождаются развитием периоперационных неврологического дефицита и летальности. Частота тромбозов в ближайшем послеоперационном периоде составляет около 1 %, что связано в основном с техническими погрешностями во время вмешательств. Другие хирургические осложнения (повреждения нервов, лимфорея) связаны с особенностями доступа (надключичный) и их частота типична. Несколько ниже процент улучшения неврологического статуса пациентов после реконструкций ПА — 80 %, что объясняется вышеописанными сложностями в определении показаний к оперативному лечению у этих больных. Проходимость после реконструкций ПА в I сегменте к 10-му году достигает 90 %, а после операций на III сегменте — 82 % [Berguer R., 1995].
Патологической извитостью сонных артерий называют случаи удлинения общих и/или экстракраниальных порций внутренних сонных артерий с образованием изгибов, перегибов (так называемых сеп-тальных стенозов) и вплоть до полных петель (может быть несколько)
на 360°. Хотя первое аутопсийное описание патологической извитости (ПИ) ВСА появилось в 1741 г., клиническое значение этого заболевания первыми, как ни странно, оценили отоларингологи в начале XX в., начав рутинно выполнять тонзиллэктомии и вскрывать пара-тонзиллярные абсцессы. Указанные операции при наличии сопутствующей ПИ чаще сопровождались повреждениями ВСА с фатальными кровотечениями. В 1951 г. М.М. Riser и соавт. впервые добились купирования симптомов ишемии головного мозга вследствие ПИ ВСА, выпрямив артерию путем фиксации ее адвентиции к пе-римизию m.sternoclaidomastoideus. В 1956 г. I.Hsu и A.D.Kistin выполнили первую реконструктивную операцию на ВСА по поводу ПИ.
Частота встречаемости ПИ сонных артерий в общей популяции неизвестна. В редких аутопсийных статистиках пациентов, умерших от других причин, приводится показатель 30 %. Ангиографические исследования показывают частоту удлинения сонных артерий от 10 до 43 % с образованием перегибов от 4 до 16 %. ПИ встречается во всех возрастных категориях, включая антенатальный период, со средним возрастом 55 лет. Соотношение мужчин к женщинам при изгибах ВСА одинаково, а при извитости ОСА 1:4. Истинную частоту возникновения СМИ при ПИ сонных артерий оценить еще труднее по двум причинам. Во-первых, нередко встречается сочетание изгиба и атеросклеротических бляшек как в участке ПИ, так и в каротидной бифуркации, а во-вторых, на возникновение симптомов церебральной ишемии при ПИ может влиять ряд факторов: уровень АД, положение головы или шеи, присутствие поражения других артериальных бассейнов в экстра- или интракраниаль-ном сегментах, учесть значение которых не всегда возможно. Тем не
менее частота развития симптомов ишемии мозга при ПИ сонных артерий описывается в 18—23 %. Операции по поводу ПИ сонных артерий выполняются в возрасте от 9,5 мес до 93 лет, в среднем 57 лет, а их частота от общего количества реконструкций на каротидной бифуркации колеблется от 1,4 до 5 %. В течение длительного времени причиной возникновения ПИ сонных артерий полагали ослабление сосудистой стенки дегенеративного характера вследствие атеросклеро-тического поражения и влияния артериальной гипертензии. Совершенствование качества неинвазив-ной диагностики (ЦДС и МРА) с появлением возможности проведения скрининговых исследований даже у детей, сопровождающиеся ростом удельного веса реконструкций по поводу ПИ в молодом возрасте и у подростков, заставили пересмотреть указанные представления. В настоящее время причиной возникновения ПИ в детском возрасте однозначно считают нарушения эмбриогенеза. Для такого предположения существуют следующие предпосылки. Оба симметричных зачатка, из которых путем слияния в дальнейшем образуется сердце, первично располагаются в области шеи зародыша. В процессе образования общих сонных артерий из участков вентральных аорт между третьей и четвертой аортальными дугами, наружных сонных артерий из более краниальных отделов вентральных аорт и внутренних сонных артерий из третьей пары жаберных артерий и участков дорсальных аорт между третьей и первой жаберными дугами сердце постепенно опускается с шеи в грудную клетку. Во время указанного перемещения сердца происходит выпрямление сонных артерий. При возникновении диспропорций между темпами роста позвоночного столба и опускания сердца в грудную клетку высока вероятность об-

Рис. 5.102. Ангиограмма больного с ПИ ВСА.
разования избыточной длины сонных артерий. С учетом того, что сонные артерии исходно достаточно плотно фиксированы на шее (устье ОСА анатомически «состыковано» с иммобилизированной подключичной артерией, НСА фиксирована множеством ветвей, а ВСА костными структурами при входе в череп), то эта вероятность повышается еще более.
Подтверждением сказанному
служит тот факт, что приблизительно у 50 % детей с удлинением сонных артерий последнее носит двусторонний характер и нередко сочетается с другими врожденными пороками развития сосудов [Rutherford R. В., 1995].
Несмотря на то что у взрослых людей двусторонняя ПИ сонных артерий встречается нередко (25 %) и у части больных с ПИ нет никаких системных проявлений атеросклероза, причины возникновения изгибов сонных артерий следует полагать более многообразными.
По всей вероятности, наряду с эмбриональными предпосылками значение имеют атеросклеротическая трансформация артериальной стенки, приводящая к ее ослаблению в области ПИ, и/или фиброзная дегенерация стенки сосуда в месте перегиба на фоне длительно существующей турбуленции потока крови, извращенного гемодинамического удара, сопровождающегося неравномерным растяжением и сокращением соседних участков артериальной стенки. Несомненен вклад артериальной гипертензии в указанные процессы, хотя она присутствует далеко не у всех больных. Развитие атеросклеротических бляшек и/или фиброзной дегенерации с течением времени в месте ПИ, помимо локальных стенозов, могут приводить к снижению прочности и эластичности сосудистой стенки на значительном протяжении прокси-мальнее и дистальнее изгиба вплоть до редкого возникновения микроаневризм.
Патофизиологически ПИ можно
разделить на два варианта: гемоди-
намически незначимые и гемодина-
мически значимые. В последнем
случае в участке изгиба артерии
возникает постоянное или времен
ное (повышение АД, определенное
положение головы) сужение, со
провождающееся турбуленцией
кровотока, что в свою очередь мо
жет приводить к образованию мик
ротромбов, агрегатов тромбоцитов
и соответственно к последующей
эмболии головного мозга.
Диагностика ПИ сонных артерий до недавнего времени основывалась исключительно на данных рентге-ноконтрастной ангиографии (рис. 5.102), так как даже использование ЦДС позволяет выявлять изгибы ВСА только на участке проксимальных 3—5 см. Внедрение в клиническую практику МРА полностью исключило этот пробел и у любого пациента с подозрением на ПИ или стенозом каротидной бифуркации
стало возможным определять изгибы ВСА вплоть до основания черепа (рис. 5.103). Для выбора тактики оперативного лечения при подтвержденной неинвазивным обследованием ПИ сонных артерий обязательной является рентгеноконтраст-ная селективная ангиография в 2 проекциях, кроме того, позволяющая детально оценить состояние интракраниального русла, что является решающим в определении показаний к хирургическому лечению.
Многие специалисты и до настоящего времени полагают естественное течение ПИ ВСА достаточно доброкачественным. В 1997 г. E.Ballotta и соавт. опубликовали результаты исследования, в котором было рандомизировано 133 пациента с ПИ ВСА на хирургическое (п=55) и консервативное лечение (п=58). Наблюдаемые группы статистически не различались между собой по исходной клинической характеристике, большинство больных имели симптомное течение заболевания (84 и 74 % соответственно). Достоверность полученных данных подкреплялась тем обстоятельством, что в исследование не включались пациенты с сочетан-ным стенозом устья ВСА (более 60 %) на стороне ПИ, а также с ПИ у основания черепа. Периопераци-онная летальность оказалась нулевой, а частота возникновения послеоперационного неврологического дефицита составила 1,8 % (1 случай ТИА). В течение 2 лет наблюдения эпизодов возникновения неврологического дефицита в группе оперированных больных отмечено не было, а среди пациентов, получавших консервативную терапию, частота очаговых расстройств составила 5,2 % (3 наблюдения полу-шарных инсультов с гемиплегией, причем во всех случаях на фоне тромбоза заинтересованной ВСА). Кроме того, 7 больных из лечившихся медикаментозно (12 %) были

Рис. 5.103. ПИ ВСА при ЦДС в ЭДК-
режиме.
направлены на хирургическое лечение в отдаленном периоде в связи с нарастанием симптомов СМИ.
Мы считаем показанным хирургическое лечение больным с ПИ сонных артерий в следующих ситуациях:
• у симптомных пациентов с ге-модинамически значимой ПИ;
• у симптомных больных с гемо-динамически незначимой ПИ при интактном состоянии интракраниального русла на стороне поражения сонной артерии;
• у асимптомных больных с гемо-динамически значимой ПИ.
Оперативная техника при ПИ внутренних сонных артерий включает три основные методики:
• резекция ВСА в устье, редрессация (выпрямление) петли или изгиба и реплантация в ОСА (рис. 5.104);
• резекция ПИ с анастомозом конец в конец между проксимальной и дистальной интактными порциями;
• протезирование ВСА.
При резекции ВСА с реплантацией избыток артерии в проксимальном отделе ликвидируется двумя способами: резекцией избыточного участка с реплантацией в ста-

Рис. 5.104. Резекция ВСА в устье, редрессация артерии и реплантация в старое устье в ОСА.
рое устье в ОСА или разрезом на ОСА, который продлевают в проксимальном направлении, а на ВСА — в дистальном, что позволяет низвести артерию за счет создания широкого анастомоза с формированием нового устья.
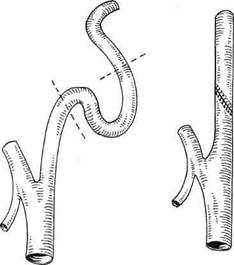
Рис. 5.105. Резекция участка ВСА, содержащего ПИ с наложением анастомоза конец в конец.
При второй методике участок ВСА, содержащий ПИ, резецируется, проксимальный и дистальный концы ВСА рассекаются по противоположным стенкам и целостность артерии восстанавливается за счет широкого косого анастомоза (рис. 5.105).
Недостатком первой методики служит то, что ВСА в сегменте, содержащем ПИ, часто полностью расправить не удается и сохраняется резидуальный стеноз. Отрицательным моментом второго типа операций является то, что далеко не всегда возможно определить точные границы интактных сегментов ВСА и то, что в результате резекции ПИ может образоваться протяженный диастаз, при котором сопоставление проксимального и диста-льного отделов ВСА неосуществимо. Сохранение измененных отделов стенки ВСА чревато риском прорезывания шва и высокой вероятностью послеоперационного тромбоза.
Исходя из вышеизложенного, мы считаем методом выбора при реконструкциях ВСА по поводу ПИ протезирование артерии, когда можно сколь необходимо широко резецировать измененный отдел артерии. Единственное преимущество техника резекции с редрессацией ВСА имеет при расположенных высоко под основанием черепа петлях ВСА, когда предпочтительнее низводить артерию, так как наложение анастомозов в этой области технически затруднительнее и несет в себе риск повреждения окружающих структур, главным образом нервных стволов.
При сочетании стеноза каротид-ной бифуркации и ПИ ВСА возможно выполнение резекции с редрессацией или протезирования артерии. В первом случае бляшка удаляется путем эверсионной ЭАЭ из ВСА после резекции избытка последней или ВСА рассекается, в открытом поле зрения выполняется
каротидная ЭАЭ и ВСА низводится с формированием новой бифуркации ВСА. При протезировании ВСА достаточно выполнения ЭАЭ только из бульбуса ОСА.
При ПИ ОСА методом выбора является резекция сегмента артерии, содержащего изгиб, с анастомозом конец в конец.
При сочетании ПИ как ОСА, так и ВСА выполняются мобилизация ОСА на протяжении (при необходимости до яремной вырезки), «перемещение» изгиба в область бифуркации, резекция ОСА в диста-льной части с «перемещенной» ПИ, ликвидация изгиба ВСА (редрессация или протезирование) и формирование анастомоза между ВСА (ее протезом) и ОСА с включением в кровоток НСА в зависимости от анатомической ситуации.
Результаты хирургического лечения ПИ сонных артерий у симп-томных больных следует признать достаточно хорошими. Практически у всех пациентов происходит купирование каких-либо проявлений СМН, периоперационная летальность составляет 0—1,6 %, а частота неврологического дефицита не превышает 1,8—3,3 %.
В сроки до 2—3 лет наблюдения случаи возникновения рестенозов, как правило, не отмечаются и больные остаются асимптомными [Bal-lotta E. et al., 1997].
Подытоживая подраздел по хирургическому лечению ПИ сонных артерий, следует отметить, что вариантов поражения при этом заболевании существует почти столько, сколько и больных, из-за чего выбор варианта реконструкции очень индивидуален и возможен только после тщательной оценки интрао-перационных находок.
Дата добавления: 2015-10-21; просмотров: 75 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Классификация сосудисто-мозговой недостаточности 5 страница | | | Фибромышечная дисплазия |