
Читайте также:
|
в течение долго времени адаптированного к низкому объемному кровотоку. Критерии прогноза кровоизлияния в мозг после реконструкций БЦА не определены.
Отдаленные результаты каротид-ной эндартерэктомии и проблема ре- стенозов ВСА. Мы проследили отдаленные результаты 167 последовательных операций каротидной ЭАЭ в средние сроки 5 лет, а максимально до 16 в собственной группе пациентов. Исходно 21 % больных был асимптомным, 27 % перенесли ТИА, 14 % имели хроническое течение СМН, а 38 % перенесли инсульт. В поздние сроки нарушения мозгового кровообращения в оперированной гемисфере были отмечены в 18 (10,8 %) случаях, причем ТИА возникли у 4,2 % больных, а инсульты — у 6,6 %. Возникновение очагового дефицита в отдаленном периоде достоверно коррелировало с исходной степенью СМН. У асимптомных пациентов его не наблюдалось вовсе, а при исходных ТИА, хроническом течении СМН и инсульте частота неврологического дефицита составила 15, 12 и 12 % соответственно. Возникновение НМК в поздние сроки не зависело от состояния контралатеральной ВСА, интракраниального русла, вида закрытия артериото-мии, присутствия артериальной гипертензии и ИБС, а определялось только степенью рестеноза и морфологической структурой рецидивировавшей бляшки.
Нормальная проходимость реконструированной ВСА (или утолщение интимы до 20 % просвета) отмечалась у 22 % больных, гемоди-намически незначимый рестеноз (от 20 до 59 %) — у 55 %, рестенозы от 60 до 79 % — у 11 %, рестенозы свыше 80 % — у 5 %, окклюзия (тромбоз ВСА) — у 7 %, т.е. гемо-динамически значимые поражения составили 23 %. Соответствующая частота асимптомного течения заболевания оказалась: 97; 95; 84; 67
и 46 %. При гомогенных бляшках частота возникновения неврологического дефицита составила 8,5 %, а при гетерогенных — 20 %.
В сроки до 2 лет после операции рестенозы представляли собой мио-интимальную гиперплазию, которая затем перерождалась в атероск-леротическую бляшку, причем пик указанной трансформации наступал к 5-му году. Для анализа рестенозов по локализации мы выделили три зоны: дистальный отдел ОСА (проксимальная), бифуркация ОСА и начальный отдел ВСА (средняя), более дистальная часть ствола ВСА (дистальная). Оказалось, что локальные (занимающие одну зону) рестенозы составляют 70 %: проксимальные — 25 %, средние — 30 % и дистальные — 15 %, а продолженные (вовлекающие несколько зон) рестенозы отмечаются в 30 % наблюдений: на протяжении 2 сегментов — 20 %, 3 сегментов — 10 %. Миоинтимальной гиперплазии соответствовали продолженные рестенозы с гомогенной эхострук-турой без кальциноза (20 %), а представленные атеросклеротиче-ской бляшкой рестенозы были локальными или состояли из гетерогенных бляшек, или были обызве-ствлены (80 %). Достоверно чаще при рестенозах свыше 60 % встречались гетерогенные бляшки (21 %), чем при гемодинамически незначимых рестенозах (6 %).
Из системных факторов достоверно на частоту развития рестенозов влияли молодой возраст (до 50 лет), обширность атеросклеретического поражения БЦА и других сосудистых бассейнов, снижение фибринолитической активности крови свыше верхней границы нормы (более 249 м/н), повышение уровня фибриногена более 3 г/л (верхняя граница нормы) и гипер-липидемия. Мы не выявили статистической взаимосвязи возникновения рестенозов с полом, сахарным диабетом и курением.
Исходный диаметр артерии не влиял на частоту рестенозов, но операции, выполненные по поводу стенозов менее 70 %, сопровождались развитием гемодинамически значимых рестенозов в 16 % наблюдений, по поводу стенозов более 90 % — в 33 %. При протяжении первичной бляшки не далее чем на 1,5 см во ВСА частота повторных гемодинамически значимых поражений составила 9,5 %, а при более распространенном — 33 %. При наличии хотя бы одного из признаков (перечисленных в порядке убывания значимости) осложненного развития первичной атеросклероти-ческой бляшки, как некроз, кровоизлияние, атероматоз, распространение атероматозных масс за пределы внутренней эластической мембраны, достоверно повышалась частота рестенозов, в том числе гемодинамически значимых с 7 до 43 %. Частота гемодинамически значимых повторных поражений ВСА при глухом шве артерии составила 30 %, при использовании заплат из ПТФЭ — 20 %, при реплантации ВСА во время эверсионной ЭАЭ — 4 %. Из них окклюзии ВСА возникли в 10; 3 и 0 % соответственно. Аутовенозные заплаты мы в настоящее время не используем, так как анализ предыдущего собственного материала показал частоту развития аневризм при таком виде пластики в 7 %. При фиксации интимы в дистальном отделе частота гемодинамически значимых рестенозов составила 23 %, когда же этот технический прием не использовался, то — 15 %. С другой стороны, применение фиксирующих швов не сопровождалось развитием тромбозов ВСА, тогда как в контрольной подгруппе частота указанного осложнения составила 6 %. Внутреннее шунтирование не влияло на частоту развития рестенозов.
Мы считаем оптимальной ширину заплат при пластике ВСА 5— 7 мм. При такой ширине частота
аневризматического расширения ВСА составила 15 % в отдаленном периоде, а при использовании заплат шире 7 мм — 71 %.
В указанные сроки наблюдения умерло 25 (17 %) больных, причем трое из них (12 %) в госпитальном периоде после реконструктивных операций на других артериальных сегментах. Мы не выявили достоверной связи между состоянием оперированной ВСА и уровнем летальности, сроком и причиной смерти. Ишемический инсульт в бассейне реваскуляризации привел к летальному исходу только в 1 наблюдении (4 %) у больного с 80 % рестенозом ВСА. В других случаях основными причинами смерти в отдаленном периоде послужили ИБС и онкологические заболевания.
Операции при рестенозах ВСА были выполнены нами в 15 наблюдениях, что составило частоту повторных вмешательств после каро-тидной ЭАЭ в отдаленном периоде 2,2 %. Средний срок до проведения повторной операции составил 6 лет (от 2 до 156 мес). Показаниями к повторным вмешательствам послужили асимптомный рестеноз более 70 % без явлений НМК в других отделах головного мозга (6 больных, 40 %), то же с явлениями НМК в других отделах головного мозга (3, 20 %) и рестеноз ВСА более 60 % с гомолатераль-ным ОНМК (6, 40 %). В целом мы рассматриваем показания к повторным вмешательствам при рестенозах ВСА после каротидной ЭАЭ следующим образом:
• симптомные рестенозы более 60%;
• асимптомные рестенозы более 70%;
• любые асимптомные рестенозы более 60 % с НМК в других отделах головного мозга.
Среди вышеуказанных 15 больных были выполнены следующие повторные операции:
• повторная каротидная ЭАЭ с применением заплаты — 4 (27 %);
• изолированная пластика ВСА без ЭАЭ - 3 (20 %);
• резекция с редрессацией ВСА —
1 (7 %);
• резекция бифуркации ОСА и ВСА с протезированием — 2 (13 %);
• резекция ВСА + ЭЭАЭ из НСА - 2 (13 %);
• подключично-наружносонное шунтирование — 1 (7 %);
• экстраинтракраниальный межартериальный анастомоз (ЭИКМА) -2(13 %).
В 6 (40 %) наблюдениях причиной рестеноза послужила атероск-леротическая бляшка, в 4 (27 %) — миоинтимальная гиперплазия и в 5 случаях наблюдался тромбоз ВСА. Осложненная бляшка (гетерогенная) с участками кровоизлияния имелась только в 1 наблюдении. Для пластики использовались заплаты из ПТФЭ, для шунтирования протез из того же материала.
Летальных исходов не было, пе-риоперационный неврологический дефицит развился в 1 наблюдении (6,7 %) при резекции ВСА с ЭАЭ из НСА. Травматизация черепных нервов была отмечена в 4 случаях (27 %), образование обширных подкожных гематом в 2 наблюдениях (13 %).
Отдаленные результаты были прослежены в средние сроки наблюдения 2 года (от 6 до 77 мес) у 12 пациентов (80 %). Ишемический инсульт развился у 1 пациента (8 %) через 55 мес после повторной операции (общесонно-внутреннесон-ное протезирование), а у 92 % больных неврологический эффект повторной реконструкции оказался полностью сохраненным. Гемодина-мически значимый повторный рестеноз возник у 2 (17 %) пациентов в среднем через 28 мес после обще-сонно-внутреннесонного протезирования и пластики ВСА. Умерло
2 (17 %) пациентов через 32 и 55 мес
от инфаркта миокарда и инсульта.
Существует группа больных с такими поражениями внутренней сонной артерии и/или ее ветвей, у которых выполнение стандартных реконструктивных операций (эндартерэктомия или протезирование ВСА) на экстракраниальном отделе ВСА невозможно:
• окклюзия ВСА;
• стеноз ВСА в интракраниаль-ном отделе;
• стеноз или сегментарная окклюзия СМА.
Предложение по созданию сообщения хирургическим путем между экстра- и интракраниальным руслом в таких ситуациях впервые высказал в 1951 г. M.Fisher, а первую операцию формирования анастомоза между поверхностной височной и средней мозговой артерией выполнили в 1962 г. R.M.P.Donag-hy и M.G.Yasargil. В 1977 г. для оценки клинической эффективности указанной операции было начато международное мультицентро-вое рандомизированное исследование, в котором при вышеуказанных типах поражения ВСА и/или СМА было рандомизировано 1377 симптомных больных: 714 на консервативное лечение и 663 на операцию [The EC-IC Bypass Study Group, 1985]. В средние сроки наблюдения 56 мес сочетанный показатель летальность + инсульт у оперированных больных оказался практически идентичным прежде всего за счет периоперационных результатов (0,6 + 2,5 %). При этом результаты хирургического лечения были сопоставимы с таковыми при консервативном у больных с двусторонними окклюзиями ВСА или СМА, т.е. в подгруппе больных, у которых эффект операции предположительно должен был оказаться наиболее очевидным. С другой стороны, при стенозах СМА результаты оперативных вмешательств оказались значительно хуже за счет возникновения окклюзии сосуда в
начальном отделе проксимальнее анастомоза вследствие падения перфузионного давления в указанном сегменте артерии после шунтирования.
Дальнейшее накопление клинического опыта и знаний по патологической физиологии мозга позволило объяснить данные вышеприведенного рандомизированного исследования и сформулировать современные показания к хирургическому лечению у описываемой категории больных. Появление таких методик как однофотонная эмиссионная томография, позитронная эмиссионная томография, ксенон-ная компьютерная томография, ТКД позволили изучать не только внутримозговой кровоток сам по себе, но и его изменения, связанные с реакцией мозговых сосудов на некоторые вазодилататоры (СО2, ацетазоламид). Было высказано предположение, что у ряда больных может отмечаться максимальное расширение резистивных сосудов в головном мозге из-за критического снижения церебрального перфузионного давления на фоне окклюзи-рующего поражения экстракраниальных отделов БЦА до такой степени, что стимуляция вазодилатации в такой ситуации не приведет к возрастанию мозгового кровотока в пораженном бассейне. Более того, при выраженных нарушениях локальной реактивности на фоне возрастания общего мозгового кровотока может происходить отток крови из зон сниженной перфузии в нормально перфузируемые, приводя к внутримозговому обкрадыванию. Иными словами, у этих пациентов нарушен церебральный перфузион-ный резерв (ЦПР), что сопровождается высоким риском развития гомолатеральных ТИА и инсультов по гемодинамическому типу при окклюзии ВСА на фоне воздействия каких-либо системных факторов (изменения АД, сердечного выброса, общего периферического со-
противления, колебаниях ОЦК, медикаментозных эффектах и т.д.).
При клиническом использовании тестов, определяющих состояние ЦПР у вышеописанных больных (КТ с ксеноном/ТКД при введении ацетазоламида/СО2), оказалось, что при сохраненном или незначительно поврежденном ЦПР риск развития неврологического дефицита составляет менее 10 % в течение 3 лет, тогда как выраженное снижение ЦПР сопровождается частотой возникновения очаговых изменений в 32—39 % случаев в сроки от 18 до 36 мес.
Кроме того, причиной развития неврологического дефицита при ок-клюзиях ВСА, но уже эмболического генеза, могут являться стенозы НСА или наличие «слепого кармана» в устье ВСА. С учетом всего вышесказанного показания к хирургическому лечению и принципы ведения больных с поражениями ВСА, когда типичная реконструктивная операция в экстракраниальном отделе невозможна, следует формулировать следующим образом.
У пациентов с окклюзией ВСА в сочетании со стенозом гомолатера-льной НСА и/или наличием «слепого кармана» в устье ВСА при возникновении стойкого или преходящего неврологического дефицита показана эндартерэктомия из НСА с пластикой последней заплатой и/или резекция ВСА с ликвидацией «слепого кармана». У тех же больных, имеющих асимптомное течение заболевания, эндартерэктомия из НСА показана при доказанном обкрадывании мозгового кровотока (антеградный кровоток или звуковой сигнал по гомолатеральной надблоковой артерии по данным периорбитальной допплерографии). При сохранении ретроградного кровотока по надблоковой артерии указанная операция показана только в качестве первого этапа оперативного лечения при необходимости выполнения типичной каротид-
ной эндартерэктомии с противоположной стороны для увеличения общего кровоснабжения мозга.
В случае сохранения симптомов ишемии мозга после ЭАЭ из НСА и/или ликвидации «слепого кармана» окклюзированной ВСА показано определение ЦПР и при его сохраненности или незначительном снижении больные переводятся на пожизненный прием дезагрегантов. При значительном снижении ЦПР показана операция формирования экстраинтракраниального микроанастомоза (ЭИКМА).
У пациентов с окклюзией ВСА и/ или СМА (в отсутствие стеноза гомолатеральной НСА и/или «слепого кармана» в устье ВСА) вне зависимости от степени СМН показано определение ЦПР и при его значительном снижении — операция формирования ЭИКМА. Остальные больные переводятся на пожизненный прием дезагрегантов.
При стенозах интракраниалъной порции ВСА и/или СМА пациенты переводятся на пожизненный прием дезагрегантов, при неэффективности такой терапии — на прием антикоагулянтов.
Формирование ЭИКМА является нейрохирургическим вмешательством, направленным на создание анастомоза по типу конец в бок между задней (теменной) ветвью поверхностной височной артерии и наиболее крупной ветвью СМА в области сильвиевой борозды путем краниотомии. Сочетанный показатель «летальность + инсульт» при таких операциях колеблется от 3 до 4 %, а 5-летняя проходимость составляет 95 % с отдаленной частотой развития неврологического дефицита около 3 %.
Среди поражений брахиоцефаль-ного ствола мы выделяем 4 морфологических варианта:
• 1-й тип поражения — изолированное поражение безымянной артерии (встречается в 67 % случаев по нашим данным);
• 2-й тип — одновременное поражение БЦС и 1-го сегмента левой ПКА (20 %);
• 3-й тип — сочетанное поражение БЦС и левой ОСА (8 %);
• 4-й тип — одновременное поражение БЦС, левой ОСА и 1-го сегмента левой ПКА (5 %).
Приведенная классификация не учитывает состояние дистальных порций экстракраниальных отделов БЦА, поражение которых встречается у больных с нарушением проходимости БЦС в 60 % наблюдений. Операции по поводу стенозов БЦС выполняются в 60 % случаев, по поводу окклюзии — в 40 %. Вовлечение дистального русла экстракраниальных сегментов БЦА при стенозах БЦС встречается у 40 % больных, тогда как при окклюзиях БЦС этот показатель возрастает до 85 %.
У наблюдаемых нами больных с поражениями БЦС асимптомными были 10 % пациентов, у 50 % имелось хроническое течение СМИ, 20 % страдали ТИА, 20 % перенесли инсульт. У больных с окклюзия-ми БЦС частота развития очагового неврологического дефицита в анамнезе в три раза превышала аналогичный показатель при стенозах сосуда. Среди больных с поражениями БЦС при интактном состоянии дистального русла или при поражении одной ВСА/одной ПА частота очагового дефицита составляет только 9 %, тогда как при сочетанном дистальном поражении одного ка-ротидного и одного или двух бассейнов ПА, а также при дистальном поражении как минимум обоих ка-ротидных бассейнов указанный показатель возрастает до 35 %. У 80 % пациентов с поражениями БЦС имелась ВБН, у 35 % ишемия в/к.
Хирургическое лечение при гемо-динамически значимых поражениях БЦС мы считаем показанным вне зависимости от степени СМИ. Основанием к операциям у асимп-томных больных является значите-
льное повышение риска развития НМК при возникновении окклюзии сосуда и сопутствующего ему более выраженного дистального поражения экстракраниальных отделов БЦА. Кроме того, по нашим данным, сочетанный показатель летальность + инсульт при операциях у асимптомных больных с поражением БЦС составил 0 %.
При стенозах БЦС без поражения бифуркации сосуда (т.е. распространения атеросклеротической бляшки на правые ПКА и/или ОСА) методом выбора является рентгенэндоваскулярная дилатация (РЭД) в силу меньшей травматичности и сопоставимости ближайших и отдаленных результатов с таковыми после открытых операций. При техническом неуспехе ангиопластики больные могут быть оперированы открытым способом практически во всех случаях.
При окклюзиях БЦС методом выбора является интраторакальная реконструкция. При 1-ми 2-м типах поражения БЦС (изолированное поражение БЦС и сочетанное поражение БЦС и левой ПКА) показана реваскуляризация только бассейна безымянной артерии, при
3 и 4 типах (сочетанное поражение
БЦС и левой ОСА или одномомен
тное проксимальное поражение
всех трех ветвей дуги аорты) пока
зана реваскуляризация как бассей
на безымянной артерии, так и ле
вой ОСА.
Техника операций при поражениях БЦС. Положение больного на спине с валиком под лопатками и головой, повернутой влево. Разрез кожи проводят по срединной линии от яремной выемки до точки на 3—
4 см ниже края мечевидного отро
стка. Выполняют полную продоль
ную стернотомию, после разведе
ния краев грудины мобилизуют ле
вую безымянную вену. Далее рассе
кают передний листок перикарда
над восходящим отделом от уровня
на 3—4 см проксимальнее корня
аорты до переходной складки перикарда, которую также пересекают по боковым стенкам аорты. Перикард разводят на держалках, которые фиксируют к ранорасширите-лю или операционному белью. Выделяют БЦС до бифуркации.
Дальнейший ход операции зависит от состояния бифуркации БЦС. При интактном состоянии бифуркации сосуда пристеночно отжимают восходящую аорту и в ней выкраивают окно. При интраторака-льных реконструкциях допустимо использование как тканых протезов, так и ПТФЭ, поскольку различий в отдаленной проходимости указанных имплантатов нет. Накладывают проксимальный анастомоз между восходящей аортой и линейным 10- или 12-миллиметровым протезом нитью пролен 4-0 непрерывным обвивным швом. После снятия зажима с восходящей аорты вводят гепарин, пережимают правые ПКА и ОСА. Далее БЦС резецируют, проксимальную культю его перевязывают и прошивают. Протез проводят под левой безымянной веной и формируют косой дисталь-ный анастомоз между дистальной порцией БЦС и протезом непрерывным обвивным швом нитью пролен 5-0 по типу конец в конец (рис. 5.91). Пуск кровотока осуществляют сначала в ПКА, затем в ОСА. На перикард накладывают узловые редкие швы. Переднее средостение и полость перикарда дренируют раздельно через контрапертуры в передней брюшной стенке тотчас под мечевидным отростком. Стальной проволокой плотно сводят края грудины, над которой затем в один ряд ушивают мышеч-но-фасциальный слой передней грудной стенки и накладывают швы на кожу.
При распространении атероскле-ротического поражения на правые ОСА и/или ПКА кожный разрез продлевают кверху и вправо от яремной вырезки в надключичную
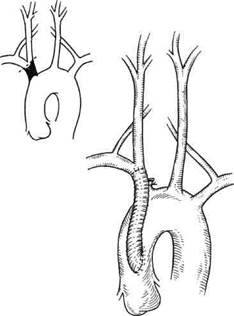
Рис. 5.91. Линейное протезирование БЦС.
область, что позволяет более широко мобилизовать начальные сегменты указанных сосудов на протяжении.
В случае локального вовлечения правой ОСА в устье или правой ПКА в первом сегменте при резекции БЦС над бифуркацией разрез продлевают по медиальной стенке ОСА или латеральной стенке ПКА на небольшом протяжении (до 2— 3 см) до интактного сегмента соответствующего сосуда. Далее локально выполняют открытую ЭАЭ из соответствующей артерии и накладывают дистальный косой анастомоз.
При поражении правых ОСА и/или ПКА на протяжении производят раздельное восстановление проходимости указанных сосудов, так как выполнение закрытой ЭАЭ сопровождается высоким риском реокклюзии трансплантата в ближайшем и отдаленном послеоперационном периоде. Правая ОСА вы-

Рис. 5.92. Раздельное восстановление проходимости правых ОСА и ПКА при поражении бифуркации БЦС.
деляется на шее до интактного сегмента (если необходимо с помощью дополнительного доступа по внутреннему краю кивательной мышцы), аналогичным образом мобилизуется правая подключичная артерия до II— III сегментов (если необходимо с помощью еще большего продления кожного разреза для стернотомии в правую надключичную область). При поражении на протяжении ОСА и интактном состоянии ПКА сонную артерию резецируют в непораженном сегменте и протез от восходящей аорты ана-стомозируют с ОСА по типу конец в конец, после чего в протез реплантируют по типу конец в бок ПКА, ранее резецированную над бифуркацией БЦС в первом сегменте. При поражении на протяжении правой ПКА и интактном состоянии ОСА протез от восходящей аорты анастомозируют с ОСА, резецированной над бифуркацией БЦС,
а далее в ОСА реплантируют ПКА или же ее проходимость (при отсутствии возможности подтянуть ПКА к ОСА из-за резекции начального сегмента первой на значительном протяжении) восстанавливают с помощью надставки из синтетического линейного протеза диаметром 8 или 10 мм (рис. 5.92). При одномоментном вовлечении на протяжении правых ПКА и ОСА указанные артерии резецируют на границе непораженных сегментов, протезом от восходящей аорты восстанавливают проходимость ОСА, а ПКА реплантируют в бок протеза либо ее проходимость восстанавливают с помощью вставки. Бифуркационное протезирование ОСА и ПКА при протезировании БЦС применяют с каждым годом все реже, поскольку в литературе появляется все больше работ, показывающих худшую отдаленную проходимость после бифуркационного протезирования в сравнении с методиками реплантации ПКА в протез ОСА или использования бокового протеза. Основная причина указанного различия — разность диаметров ОСА и ПКА, а также объемов перфузии по этим сосудам, анастомо-зируемым с одинаковыми бранша-ми бифуркационного протеза.
Если у больного, которому требуется протезирование БЦС, имеется клинически значимое поражение ВСА справа, то техника одномоментного восстановления нормальной проходимости ВСА определяется состоянием ОСА. При интактном состоянии ОСА или ее поражении в начальном отделе проводят типичное протезирование БЦС, при необходимости дополняемое открытой ЭАЭ из ОСА на ограниченном участке, а затем выполняют классическую каротидную ЭАЭ через отдельный доступ на шее. При поражении средней и/или дисталь-ной порций ОСА протез от восходящей аорты выводят на шею, ОСА резецируют на уровне бифуркации,
выполняют каротидную ЭАЭ и накладывают анастомоз по типу конец в конец между протезом и бифуркацией ОСА.
При необходимости одномоментной реваскуляризации правой ПА при протезировании БЦС восстановление нормальной проходимости указанной артерии осуществляется либо путем ЭАЭ (стандартной или из просвета резецированной на уровне отхождения ПА правой ПКА), либо после резекции позвоночной артерии с реплантацией в правые ПКА или ОСА или надставку между последними сосудами в зависимости от интраоперационной ситуации.
Вопрос об одномоментности протезирования БЦС и каротидной ЭАЭ слева должен решаться индивидуально у каждого пациента в зависимости от конкретной клинической ситуации. Указанное обстоятельство связано с повышением риска развития в послеоперационном периоде гиперперфузионного синдрома вплоть до кровоизлияния в мозг при одномоментном вмешательстве. При этапном хирургическом лечении в данной ситуации в первую очередь проводится реваскуля-ризация бассейна БЦС.
При необходимости одномоментного протезирования безымянной артерии и левой ОСА (3-й и 4-й типы поражения БЦС) перед наложением проксимального анастомоза с восходящей аортой в протезе БЦС выкраивают боковое окно, куда подшивают по типу конец в бок линейный синтетический протез 8 или 10 мм для левой ОСА. Далее протез БЦС анастомозируют с восходящей аортой, и последующий ход операции определяется характером поражения первых двух ветвей дуги аорты. При окклюзии БЦС и стенозе левой ОСА в первую очередь восстанавливают кровоток в бассейне БЦС, в остальных клинических ситуациях (стенозы как БЦС, так и левой ОСА, окклюзия
обеих указанных артерий и стеноз БЦС + окклюзия левой ОСА) в первую очередь протезируют левую ОСА. При интактном состоянии левой ВСА резекцию левой ОСА для наложения дистального анастомоза производят на границе непораженного сегмента. При необходимости одномоментного проведения гомолатеральной каротидной ЭАЭ левую ОСА для наложения дистального анастомоза резецируют над бифуркацией.
Необходимость множественного шунтирования ветвей дуги аорты, по нашим данным, возникает в 30 %, а одномоментной гомо- и контрала-теральной каротидной ЭАЭ — в 10 % случаев.
Непосредственные результаты операций при поражениях БЦС достаточно разноречивы у различных авторов. Так, летальность колеблется от 3 до 8 % в среднем, но в некоторых, даже крупных (до 50— 60 операций), статистиках является нулевой. Наши данные летальности по 46 интраторакальным операциям при поражениях БЦС составляют 4,3 % (Белоярцев Д.Ф., 1999). Такие же различия существуют в оценке периоперационного неврологического дефицита от 0 до 3—6 %, возникновение которого связано прежде всего с ранними послеоперационными тромбозами: от 0 до 2,4—14,3 % (собственный опыт — 6,5 %). Немедленная повторная операция при тромбозе в ближайшем послеоперационном периоде вследствие, как правило, технических погрешностей во время первого вмешательства в большинстве случаев позволяет эффективно восстановить проходимость протеза.
Специфичным и очень грозным осложнением описываемых вмешательств является медиастинит, также встречающийся от 0 до 4,5—9 % случаев. Следует отметить, что, по нашим данным, инфицирование стернотомической раны является существенным фактором риска
тромбоза протеза, приводя к последнему осложнению в 33 % наблюдений в течение 30-дневного периода после операции. Современные принципы хирургической обработки раны, ее адекватного дренирования, моменто- или мио-пластики позволяют в большинстве случаев добиться купирования воспалительного процесса, заживления стернотомической раны первичным натяжением и сохранения проходимости протеза.
Непосредственные результаты РЭД при стенозах БЦС, не вовлекающих бифуркацию сосуда, следует расценивать как достаточно хорошие. В нашей группе из 27 больных восстановить проходимость БЦС удалось в 93 % наблюдений, причем пациенты с техническим неуспехом при РЭД в дальнейшем были оперированы стандартным способом в плановом порядке. Летальность при РЭД БЦС составила
3.7 % (1 больной умер от последст
вий ишемического инсульта, раз
вившегося во время вмешательства,
на этапе освоения методики). Об
щая частота неврологического де
фицита была 11,1 %, но все эти
случаи наблюдались во время пер
вых баллонных ангиопластик, вы
полнявшихся в 80-х годах, и их
прежде всего следует связывать с
недостатком опыта.
Отдаленные результаты операций при поражениях БЦС: проходимость протезов и/или реконструированных сосудов в нашей группе больных в сроки до 14 лет (средний период наблюдения
6.8 лет) была сохранена у 91 % па
циентов. Кумулятивная проходи
мость к 5-му году достигала 90 % и
оставалась таковой до 15-го года
наблюдения.
Неврологический эффект сохранялся у 75 % больных, причем кумулятивная клиническая эффективность вмешательства к 5-му году составляла 89 %, а к 10-му — 63 %. Очаговый неврологический дефи-
цит развился в 9 % наблюдений, а кумулятивная частота НМК до 15-го года не превышала 10 %. Повторные инсульты в оперированных бассейнах среди больных с исходным дооперационным неврологическим дефицитом возникли только в 12 % случаев.
Кумулятивная выживаемость к 5-му году составляла 93 %, а к 10-му — 64 %. Инсульт не послужил причиной смерти ни у одного пациента.
Сообщения о повторных опера
циях в отдаленные сроки после ин-
траторакальных реконструкций
единичны; их причиной служат симптомные тромбозы шунтов или, крайне редко, развитие инфекции протеза в отдаленные сроки. Тактических вариантов здесь немного: это попытки выполнить экстраторакальное шунтирование или другой вариант внутригрудной реконструкции. Часто никакая типичная операция уже неосуществима из-за поражения всех возможных для использования в качестве донорских ветвей дуги аорты и тогда в исключительных случаях можно использовать повторное протезирование в условиях глубокой гипотермии и остановки кровообращения или бедренно-брахиоцефальные реконструкции. В каждом из приведенных источников опыт был ограничен единственным наблюдением, поэтому обсуждать эффективность таких вмешательств затруднительно, но их высокая травматичность и оперативный риск сомнения не вызывают. При поздней инфекции требуется еще и удаление старого протеза.
Дата добавления: 2015-10-21; просмотров: 126 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Классификация сосудисто-мозговой недостаточности 3 страница | | | Классификация сосудисто-мозговой недостаточности 5 страница |