
Читайте также:
|
Отдаленные результаты РЭД при стенозах БЦС: в сроки наблюдения до 9,5 лет (в среднем 5 лет) реок-клюзия БЦС развилась в 1 наблюдении (5,6 %) без ухудшения клинического состояния пациента, что в кумулятивных показателях составило 100 % проходимость к 5-му году наблюдения и 90 % — к 10-му.
Неврологический эффект дилата-ции БЦС был сохранен у 89 % больных, что составило в кумулятивных показателях к 5-му году 86 %, а к 10-му — 57 %. Инсульт в отдаленные сроки возник у 1 пациента (5,6 %) только на 9-м году наблюдения, причем ни разу у больных, имевших исходный неврологический дефицит. Ни один больной не погиб от ОНМК. Выживаемость к 5-му году достигала 100 %, к 10-му - 61 %.
К проксимальным поражениям подключичных артерий относят случаи развития непроходимости I сегмента ПКА (проксимальнее уровня отхождения позвоночной артерии). По нашим данным, соотношение стенозов к окклюзиям при поражении I сегмента ПКА составляет 1:2, а вовлечения правой и левой ПКА 1:3. У 66 % больных проксимальное поражение ПКА не сопровождается вовлечением других дистальных отделов БЦА, в 17 % наблюдений имеется сопутствующее гомолате-ральное поражение ПА и/или II сегмента подключичной и еще в таком же проценте случаев присутствует вовлечение одной или обеих ВСА и/или контралатеральной ПА. Двустороннее проксимальное поражение ПКА встречается в 1,7 % наблюдений.
По нашим данным, 18 % оперируемых больных имеют асимптом-ное течение СМН, 6 % страдают ТИА, 58 % имеют III степень СМН, 18 % оперируются после инсультов. У 79 % пациентов присутствует ВБН, у 49 % — ишемия руки, причем в 5 % случаев критическая. Следует отметить, что среди асимп-томных по СМН больных ишемия в/к встречается в 55 % случаев, причем в 10 % носит критический характер.
Хирургическое лечение при проксимальных поражениях ПКА показано вне зависимости от степени СМН, а основанием к операции служит доказанный синдром позво-
ночно-подключичного обкрадывания. Так, в нашей группе с поражениями ПКА среди больных с IV степенью СМН 52 % пациентов имели ишемические очаги в больших полушариях на фоне интакт-ного состояния экстракраниальных отделов обоих каротидных бассейнов, причем у 27 % из них присутствовало двустороннее очаговое повреждение.
При окклюзии ПКА в I сегменте показана операция, при стенозах — рентгенэндоваскулярная ди-латация.
Техника операций при поражениях ПКА. Операциями выбора при непроходимости I сегмента ПКА являются резекция подключичной артерии с реплантацией в общую сонную артерию и сонно-подключичное шунтирование. При необходимости ЭАЭ из позвоночной или II сегмента подключичной артерий предпочтение имеет операция резекции ПКА с реплантацией в ОСА. При возможности перегиба позвоночной артерии во время подтягивания подключичной к сонной артерии (отхождение последней от задней или нижней стенок ПКА, отхождение от ПКА под острым углом) показано сонно-подключичное шунтирование. Если в указанной ситуации необходимо восстановление проходимости позвоночной артерии, то выполняется раздельная имплантация ПКА и ПА в ОСА. При возможности перегиба позвоночной и необходимости одномоментной ЭАЭ из нее и подключичной артерий требуется сонно-подключичное шунтирование с резекцией ПА и ее реплантацией в протез или ОСА. При проксимальном отхождении позвоночной артерии ее устье располагается в грудной полости и его невозможно мобилизовать для проведения типичной реплантации из надключичного доступа. В такой ситуации операцией выбора служит сонно-подключичное шунтирование.
Резекция ПКА с реплантацией в ОСА выполняется из надключичного доступа. Положение больного — на спине с валиком под лопатками и головой, повернутой в сторону, противоположную разрезу. Разрез кожи производят на 1 см выше ключицы и параллельно ей, начиная от точки между головками гру-диноключично-сосцевидной мышцы и заканчивая у переднелатераль-ного края трапециевидной мышцы. После рассечения подкожной мышцы шеи и латеральной головки ки-вательной мышцы пересекают наружную яремную вену и разделяют прескаленную клетчатку, после чего в ране обнажаются поверхностно и медиально лежащая медиальная головка кивательной мышцы, глубже и центрально расположенная передняя лестничная мышца с продольно лежащим на ее передней поверхности диафрагмальным нервом, а в латеральном углу раны визуализируются пучки плечевого сплетения. В медиальном углу раны под медиальной головкой кивательной мышцы и под внутренней яремной веной выделяют общую сонную артерию на максимальном протяжении от грудиноключичного сочленения и вверх по ходу сосудисто-нервного пучка на шее, берут на держалку и под внутренней яремной веной вытягивают в надключичную область. Аккуратно перемещая диафрагмальный нерв со слоем окружающей периневрий клетчатки, полностью пересекают переднюю лестничную мышцу и подключичную артерию мобилизуют во II сегменте. Последовательно пересекают и прошивают ветви II сегмента подключичной артерии: реберно-шейный и щито-шейный стволы и внутреннюю грудную артерию. После мобилизации во II сегменте становится возможным достаточно свободно перемещать в ране подключичную артерию, которая далее выделяется в проксимальном направлении до уровня отхож-
дения позвоночной артерии. Последнюю выделяют на протяжении до входа в канал поперечных отростков шейных позвонков. Далее подключичную артерию мобилизуют еще более проксимально в грудной полости так, чтобы после пересечения образовалась культя подключичной артерии проксимальнее устья позвоночной длиной не менее 1 см. При манипуляциях в данной области следует помнить о возможности повреждения позвоночных вен, грудного лимфатического протока, нередко представленного несколькими стволами, и купола париетальной плевры. Вводят гепарин, пережимают подключичную артерию центрально и во II сегменте, а также позвоночную артерию. После резекции подключичной артерии ее культю прошивают и перевязывают. Проводят пробу с пережатием общей сонной артерии, при толерантности мозга к пережатию на сонную артерию накладывают два зажима и в выключенном участке выкраивают окно по боковой стенке сосуда. По типу конец в бок производят реплантацию подключичной артерии в общую сонную непрерывным обвивным швом нитью пролен 5-0 (рис. 5.93). Заднюю губу анастомоза формируют на расстоянии. Перед пуском кровотока снимают зажим с подключичной артерии, последовательно промывают дистальное русло подключичной артерии путем снятия и повторного наложения зажима. При окончательном пуске кровотока последовательно снимают зажимы в той же последовательности. Рану дренируют через латеральный угол над ключицей, сшивают латеральную головку кивательной мышцы, зашивают подкожную мышцу шеи и накладывают швы на кожу (рис. 5.94).
При одновременном непротяженном поражении позвоночной артерии и/или второго сегмента ПКА выполняют открытую через
просвет пересеченного сосуда или эверсионную ЭАЭ из указанных артерий, а затем производят реплантацию в сонную артерию, как описано выше. Если бляшка распространяется в позвоночную артерию на значительном протяжении и удалить ее через просвет подключичной не представляется возможным, то позвоночную артерию резецируют и выполняют открытую или эверсионную ЭАЭ из нее, а затем производят раздельную реплантацию подключичной и позвоночной артерий в общую сонную. При протяженном поражении II сегмента ПКА последнюю рассекают по передней стенке, выполняют открытую ЭАЭ из подключичной и при необходимости из позвоночной артерии. Проходимость указанных сосудов восстанавливают с помощью вставки из 8-миллиметрового ПТФЭ-протеза, проксимальный анастомоз накладывают по типу конец в бок с ОСА, а дистально выполняют широкий косой анастомоз на всем протяжении рассеченной ПКА по типу конец в конец.
Сонно-подключичное шунтирование также выполняют полностью из надключичного доступа. ОСА выделяют способом, аналогичным описанному выше. ПКА выделяют только на протяжении II сегмента. Проксимальный анастомоз накладывают несколько косо по типу конец в бок между окном по боковой поверхности ОСА и 8-миллиметровым ПТФЭ-протезом, который срезают так, чтобы краниальный угол анастомоза оказался тупым. Этот прием позволяет уменьшить выраженность турбуленции по сравнению с проксимальным анастомозом, накладываемым под прямым углом. Далее подключичную артерию рассекают по передней стенке во II сегменте на протяжении 1,5— 2 см и формируют широкий косой дистальный анастомоз по типу конец в бок между протезом и ПКА непрерывным обвивным швом ни-

Рис. 5.93. Резекция ПКА с реплантацией в ОСА.
тью пролен 6-0 (рис. 5.95). Учитывая то, что даже в интактном состоянии стенка подключичной артерии довольно тонка и легко прорезается, предпочтительнее проши-

Рис. 5.94. Ангиограмма больного С. через 6,5 года после резекции левой ПКА с реплантацией в ОСА. Подключич-но-сонный анастомоз полностью проходим, отмечается хорошее антеградное заполнение левой ПА и дистального русла левой ПКА.

Рис. 5.95. Сонно-подключичное шунтирование.
вать медиальный угол дистального анастомоза на расстоянии. С этим же обстоятельством связан выбор нити 6-0. Протез должен располагаться не по прямой наикратчайшей линии между ОСА и ПКА, а иметь некоторую избыточную длину та-
ким образом, чтобы он образовывал небольшую дугу, обращенную кверху и кпереди, что позволяет избежать перегиба шунта на проксимальном анастомозе. Преимущества и недостатки операций резекции ПКА с реплантацией в ОСА и сонно-подключичного шунтирования приведены ниже.
Чаще всего оказывается, что преимущества и недостатки указанных типов реконструкций уравновешивают друг друга и выбор вмешательства зависит от предпочтений хирургов, поскольку ближайшие и отдаленные результаты этих операций практически идентичны. Вместе с тем определенные узкие показания к реплантации или шунтированию существуют.
Показанием к выполнению операции сонно-подмышечного шунтирования для ликвидации синдрома позвоночно-подключичного обкрадывания является один из вариантов анатомического расположе-

ния подключичной артерии, когда сосуд не выходит из грудной клетки полностью в надключичную область, располагаясь на уровне ключицы или ниже ее. В такой ситуации попытка мобилизовать подключичную артерию надключичным доступом либо невозможна, либо сопряжена с высоким риском повреждения купола париетальной плевры и подключичной вены.
Общая сонная артерия выделяется типично на шее надключичным доступом. Подмышечная артерия выделяется подключичным доступом. Разрез кожи выполняется в проекции первого межреберья под ключицей отступя на 2—3 см от латерального края большой грудной мышцы и несколько не доходя до нижнего края ключицы. После рассечения грудной фасции тупо раздвигаются волокна большой грудной мышцы и в trigonum clavipecto-rale, содержащем подмышечный сосудисто-нервный пучок, окруженный клетчаткой, мобилизуется подмышечная артерия в I сегменте между ключицей и медиальным краем малой грудной мышцы. Сзади артерии в этом участке находится медиальный пучок плечевого сплетения, сверху и снаружи — задний и латеральный пучки, а снизу и внутри — подмышечная вена.
Первым по типу конец в бок формируют проксимальный анастомоз между 8-миллиметровым ПТФЭ-протезом и ОСА, далее восстанавливают кровоток по сонной артерии и протез под ключицей выводят в подмышечную ямку. Подмышечную артерию вскрывают по передней стенке на протяжении 1,5—2 см и накладывают косой дис-тальный анастомоз по типу конец в бок нитью пролен 6-0 непрерывным обвивным швом. Как и при формировании дистального анастомоза при сонно-подключичном шунтировании, с учетом тонкости и склонности стенок подмышечной артерии к прорезыванию медиаль-
ную губу дистального анастомоза предпочтительнее формировать на расстоянии. При ушивании раны подключичной области сшивают большую грудную мышцу вместе с грудной фасцией и затем накладывают швы на кожу. Рану дренируют через контрапертуру к нижнелатеральному углу сквозь большую грудную мышцу. По нашим данным, необходимость в выполнении сонно-подмышечного шунтирования возникает приблизительно в 2 % случаев реконструкций ПКА.
Если головной мозг больного не толерирует пережатие сонной артерии, в такой ситуации для ликвидации синдрома позвоноч-но-подключичного обкрадывания выполняют операции экстраанатомического шунтирования — подмышечно-подмышечного или сонно-подключичного от контра-латеральной ОСА.
При подмышечно-подмышечном шунтировании с двух сторон подключичными доступами выделяют подмышечные артерии и шунтируют их ПТФЭ-протезом от донорской («здоровой») артерии в подмышечную артерию на стороне поражения. Протез проводят антестерна-льно под кожей (рис. 5.96). К недостаткам данного типа реконструкций относятся плохая отдаленная проходимость шунтов и высокий риск инфицирования протеза за счет деструкции и инфицирования растянутой над протезом кожи там, где трансплантат перекидывается через грудину. По нашим данным, необходимость в выполнении подмышечно-подмышечного шунтирования возникает приблизительно в 5 % случаев реконструкций ПКА.
В тех случаях, когда подмышеч-но-подмышечное шунтирование невозможно (двустороннее поражение подключичных артерий) допустимо выполнение сонно-подключичного шунтирования от контралате-ралъной ОСА. Указанные артерии

|
Рис. 5.96. Подмышечно-подмышечное шунтирование.
типичными доступами (ОСА мобилизуется максимально низко) выделяют на обеих сторонах шеи и ПТФЭ-протез проводят от сонной к подключичной артерии под медиальными головками кивательных мышц кпереди от трахеи. К недостаткам таких вмешательств относятся низкая проходимость трансплантатов и выраженный дискомфорт у больного, постоянно чувствующего пульсацию протеза за счет компрессии последним трахеи в яремной вырезке. По нашим данным, необходимость в выполнении такого варианта сонно-подключичного шунтирования возникает приблизительно в 1 % случаев реконструкций ПКА.
Непосредственные результаты хирургического лечения при проксимальных поражениях ПКА следует считать достаточно хорошими. Так, по нашим данным, положительная динамика неврологических симптомов отмечается у 96 % больных, причем 80 % отмечают полное купирование проявлений СМН. Частота летальных исходов колеблется
в пределах 0,8—2,4 %, нередко в крупных статистиках по 100—200 наблюдений являясь нулевой. По нашим данным, летальность составила 1 %. Специфичными осложнениями при таких вмешательствах являются гидро- и хилоторакс, лимфорея из послеоперационной раны, парез возвратного нерва, развитие синдрома Горнера, плечевого плексита. Частота указанных осложнений, по данным литературы, может меняться от 5,4 до 20 %. В нашей группе больных этот показатель составил 9,8 %. Возникновение периоперационных тромбозов описывается с частотой от 0 до 6 %. В наших наблюдениях этот показатель составил 1,3 %.
Отдаленные результаты хирургического лечения при проксимальных поражениях ПКА были нами изучены в сроки до 14 лет (средний период наблюдения — 6 лет). Проходимость реконструированных артерий была сохранена у 97 % пациентов, что в кумулятивных показателях достигало к 14-му году наблюдения 96 %. По литературным
данным, проходимость к 5-му году в крупных статистиках описывается на уровне 86—100 % [Белоярцев Д.Ф., 1999]. У 96 % пациентов сохранялся клинический эффект выполненной реконструкции, причем в 80 % наблюдений больные имели асимптомное течение СМН. Кумулятивные показатели неврологической эффективности выполненной операции составили 94 % к 5-му году наблюдения и 86 % к 10-му. Частота инсультов в поздние сроки в оперированном бассейне составила 2,5 %. Выживаемость к 5-му году наблюдения составляла 87 %, к 10-му году — 73 %. Ни в одном случае инсульт в оперированном бассейне не послужил причиной смерти в поздние сроки.
Отдаленные результаты РЭД при проксимальных поражениях ПКА были изучены в средние сроки около 5 лет (максимальный период наблюдения — 13 лет). Отдаленная проходимость во время всего периода наблюдения сохранялась на уровне 100 %. Клинический эффект после дилатации сохранялся у 73 % больных, причем 45 % оставались асимптомными, что составило кумулятивное сохранение неврологического эффекта операции в 74 % случаев к 5-му году и 46 % к 10-му году наблюдения. Инсульты в оперированном бассейне были отмечены у 5,5 % пациентов, что в кумулятивных показателях достигало только 10 % к 13-му году наблюдения.
Последнюю группу проксимальных поражений составляют случаи вовлечения общих сонных артерий. Как правило, у этих больных выявляется окклюзия ОСА (90 % наблюдений по нашим данным) и у 60 % уже имеется непроходимость гомо-латеральной ВСА на момент обращения к хирургу. Клинически у 85 % пациентов присутствует очаговый неврологический дефицит, а асимптомного течения СМН в нашей группе больных не отмечалось вовсе.
Хирургическое лечение при поражениях ОСА показано при любой степени СМН при наличии проходимости хотя бы гомолатеральной НСА. При локальных стенозах ОСА показана РЭД.
Операцией выбора при пораже
ниях ОСА является подключич-
но-сонное шунтирование. Вмеша
тельство начинается с выделения
бифуркации ОСА доступом по
внутреннему краю кивательной
мышцы как при каротидной ЭАЭ.
При ревизии оценивается проходи
мость НСА и/или ВСА и, если ре
конструкция технически осущест
вима, то далее производится выде
ление подключичной артерии на
стороне поражения ОСА типичным
надключичным доступом. Затем
ОСА резецируется на 1,5—2 см
ниже бифуркации, проксимальный
конец ее перевязывается с проши
ванием и оценивается проходи
мость ВСА и НСА. Если ВСА про
ходима, то латеральная стенка ОСА
рассекается с переходом на ВСА на
протяжении, достаточном для вы
полнения при необходимости от
крытой ЭАЭ из ВСА. При сужении
начального отдела НСА выполняет
ся ЭАЭ из последней как при ти
пичной каротидной ЭАЭ. При ин-
тактном состоянии бифуркации
ОСА разрез в любом случае продле
вается на ВСА, чтобы длина диста-
льного анастомоза составляла не
менее 2,0—2,5 см. Накладывается
дистальный анастомоз с бифурка
цией ОСА с переходом на ВСА не
прерывным обвивным швом нитью
пролен 5-0. Мы не выявили разли
чия в отдаленной проходимости
между аутовенозными шунтами и
протезами из ПТФЭ, поэтому в на
стоящее время используем только
синтетические протезы, так как это
сокращает время операции и позво
ляет сохранить аутовену для рекон
струкций ниже паховой складки
или АКШ. При проходимости ВСА
применяется 8-миллиметровый
протез из ПТФЭ.

|
ного вмешательства присутствовал в 90 % наблюдений. Периопераци-онных инсультов и тромбозов не было.
Отдаленные результаты прослежены в сроки до 10 лет (средний период наблюдения — 3,5 года). Частота поздних тромбозов составила 18 %, а проходимость в кумулятивных показателях оказалась 90 % к 3-му году наблюдения (рис. 5.98) и 65 % — к 8-му году. Асимп-томными оставались 50 % больных, а эффект операции был сохранен у 80 % пациентов, что составило в кумулятивных показателях 60 % к 8-му году наблюдения. Возникновения неврологического дефицита в поздние сроки не отмечено.
При описании поражений позвоночной артерии последняя анатоми-
Рис. 5.97. Подключично-сонное шунтирование.
При окклюзии ВСА последнюю резецируют, как и НСА. Выполняют перевязку ВСА, а НСА рассекают на протяжении 2—2,5 см или более, если это необходимо для выполнения адекватной ЭАЭ. Далее аналогичным образом формируют дистальный анастомоз между НСА и 6-миллиметровым ПТФЭ-проте-зом.
Протез выводят под кивательной мышцей в надключичную ямку и накладывают проксимальный анастомоз во II сегменте подключичной артерии по типу конец в бок непрерывным обвивным швом нитью пролен 6—0 (рис. 5.97). Закрывают раны стандартно.
Результаты операций подключич-но-сонного шунтирования: полное купирование исходных неврологических симптомов после вмешательства было отмечено нами у 48 % больных, а значительное уменьшение их выраженности у 42 %, т.е. положительный эффект оператив-

Рис. 5.98. Ангиограмма больного Л. через 2 года после подключично-наруж-носонного аутовенозного шунтирования справа. Шунт и анастомозы полностью проходимы, отмечается хорошее контрастирование дистального русла НСА справа.
чески подразделяется на четыре сегмента (рис. 5.99):
• первый — от устья до входа в костный канал на уровне поперечного отростка С6;
• второй — от С6 до выхода из костного канала на уровне поперечного отростка С2;
• третий — от С2 до атлантоокци-питальной мембраны на основании черепа;
• четвертый — интракраниаль-ный до слияния с контралатераль-ной ПА в основную артерию.
Причинами поражения ПА в I сегменте являются атеросклероз и патологическая извитость. Нарушения проходимости ПА во II сегменте возникают вследствие изменения уровня входа (С7, C5) и/или выхода (Сз) из костного канала либо за счет сдавления остеофитами в самом канале. Крайне редкие поражения ПА в III сегменте связаны, как правило, с расслоением сосуда вследствие фибромышечной дисплазии и(или) травмы, обусловленной подвывихом двух верхних шейных позвонков, что приводит к образованию аневризмы либо стеноза ПА в указанном отделе. Следует отметить, что даже при окклюзии ПА в начальной порции ее III сегмент остается нередко проходимым за счет хороших коллатеральных связей с системой НСА через затылочную артерию, а иногда сохраняется проходимость ПА и во II сегменте за счет таких же связей с ветвями второй порции ПКА. Поражение ПА в интракраниальных сегментах связано с атеросклерозом и является второй по частоте локализацией указанного процесса после поражений ПА в устье.
В диагностике клинической значимости поражений ПА очень важное значение имеет рутинное применение МРТ, которая, в отличие от стандартной КТ, более точно описывает ишемические повреждения задних отделов мозга. При нарушениях входа ПА в костный канал и выхода из него наибольшей

Рис. 5.99. Деление ПА на сегменты.
диагностической ценностью обладает спиральная КТ с трехмерной реконструкцией. ЦДС имеет меньшее значение в топической диагностике поражений из-за трудности локализации ПА в устье и костном канале. Наиболее точным методом в определении анатомической локализации поражений ПА продолжает оставаться рентгеноконтраст-ная ангиография. Визуализация дуги аорты позволяет выявить варианты отхождения левой ПА от дуги, реже правой ПА от безымянной или правой ОСА. Для детального определения состояния устьев ПА требуются косые проекции. Из-за частого наложения изображения ПКА на позвоночную нередко требуется дополнительная ротация больного в косых проекциях для более четкого выведения устьев по-
следних на экран. При подозрении на непроходимость ПА во II сегменте (возникновение симптомов ВБН при поворотах головы, ее запрокидывании или наклоне) требуется введение контрастного вещества селективно в подключичную артерию при максимальных поворотах головы вправо и влево или наклоне кпереди и кзади. Также важно определение состояния интрак-раниальных артерий ВББ при выборе тактики лечения (см. выше).
Хирургическое лечение при экстракраниальных поражениях позвоночных артерий мы считаем показанным у больных с симптомами ВБН, если только исключены клинически значимые вовлечения сосудов каротидного бассейна и проксимальные поражения ветвей дуги аорты или реконструкция тех и других невозможна. Оперативное вмешательство может привести к ликвидации или уменьшению выраженности симптомов ВБН только при двустороннем поражении ПА или вовлечении доминантной ПА, если имеется нарушение компенсации через задние соединительные артерии и отсутствует поражение основной артерии и/или интракра-ниального сегмента вовлеченной ПА либо интракраниальных сегментов обеих ПА.
При всех других вариантах поражения ВББ решение о проведении реконструкции ПА при наличии очаговой вертебробазилярной симптоматики требует доказательства присутствия источников эмболии в артериальном русле, а при хроническом течении ВБН хирургическое лечение неэффективно. Если после коррекции проксимальных и/или дистальных поражений каротидного бассейна сохраняется клиника ВБН, то во вторую очередь проводится реконструкция ПА по приведенным выше показаниям.
Среди реконструкций ПА в I сегменте (стеноз, патологическая извитость) операцией выбора является
резекция артерии с реплантацией в ОСА. ПА и ОСА выделяют через типичный надключичный доступ, ПА резецируют в устье, которое ушивают. При необходимости производят открытую или эверсионную эндар-терэктомию из ПА, в заднебоковой стенке ОСА выкраивают эллипсовидное окно, куда непрерывным об-вивным швом нитью пролен 6-0 имплантируют рассеченную по перед-небоковой стенке ПА.
Другим вариантом операции является резекция ПА с реплантацией в старое или новое (более дисталь-но расположенное) устье в ПКА. Данная методика применяется реже, так как частота атеросклеро-тического поражения ОСА значительно уступает частоте вовлечения ПКА. Имплантация ПА в ПКА допустима в основном у пациентов молодого возраста с изгибами ПА, а также показана у больных, не толе-рирующих пережатие ОСА.
Оба типа реконструкций ПА позволяют выполнить при необходимости протяженную эндартерэкто-мию (эверсионную) из I сегмента артерии, что невозможно при трансподключичном способе восстановления нормальной проходимости ПА, который применим только в случае локальных стенозов в устье артерии. Трансподключичную эн-дартерэктомию выполняют в двух модификациях. В первом случае вокруг устья ПА по стенке подключичной артерии производят полукружный разрез, который после удаления бляшки из ПА ушивают наглухо. Во втором случае вскрывают просвет ПА с переходом на стенку ПКА, в открытом поле зрения выполняют эндартерэктомию и арте-риотомию обоих сосудов закрывают с помощью общей заплаты. Трансподключичные реконструкции ПА показаны только у нетолерантных к пережатию ОСА пациентов с локальными стенозами в устье.
Реваскуляризация ПА в III сегменте выполняется при окклюзии арте-
рии в I (одновременно в I и И) сегменте, нарушениях проходимости сосуда во II сегменте и крайне редко при изолированных поражениях в III сегменте. Кожный разрез при указанной операции производится как при каротидной эндартерэкто-мии. Разделяются ткани между внутренней яремной веной и медиальным краем кивательной мышцы и на дне промежутка между ними становится видным добавочный нерв. Последний аккуратно обходится держалкой и выделяется кверху до участка, в котором он приходит в соприкосновение с яремной веной и пересекает поперечный отросток С1. Для того чтобы четко прощупать указанный отросток, требуется освободить и отодвинуть двубрюшную мышцу кверху. Далее становится возможным определить местонахождение поперечного отростка С2, над которым перекидывают m.levator scapulae. Последнюю после удаления предлежащей жировой клетчатки пересекают и ее проксимальный отрезок иссекают до места прикрепления к поперечному отростку первого позвонка для расширения доступа. Далее становится виден передний корешок С2, который перпендикулярно перекидывается через ПА и затем делится на три нервных ствола. Корешок пересекают про-ксимальнее развилки и под ним определяют ПА (рис. 5.100). Мобилизация ПА в этом отделе требует особой тщательности из-за тесного контакта с окружающими венами и возможностью повреждения артериальной коллатерали к затылочной артерии при проведении держалки. Применение увеличивающей оптики повышает безопасность указанных манипуляций.
Далее выполняют непосредственно реваскуляризацию ПА в III сегменте, которая возможна в нескольких вариантах, из которых предпочтение отдается шунтированию реверсированной аутовеной от дис-тальной порции ОСА (рис. 5.101).
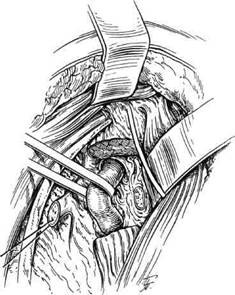
Рис. 5.100. Доступ к III сегменту ПА.

Рис. 5.101. Аутовенозное шунтирование III сегмента ПА от ОСА.
Дата добавления: 2015-10-21; просмотров: 156 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Классификация сосудисто-мозговой недостаточности 4 страница | | | Классификация сосудисто-мозговой недостаточности 6 страница |