
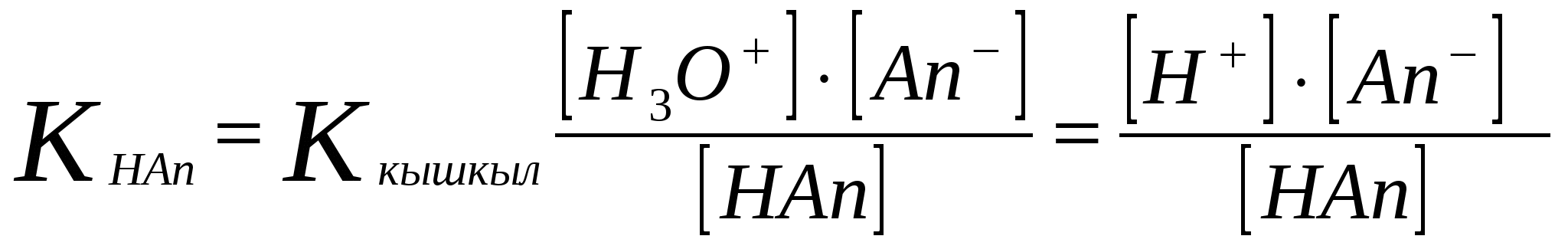 ; [H3O] = [An-];[An-] = Cтұз
; [H3O] = [An-];[An-] = Cтұз
[НAn] = Cқышқыл

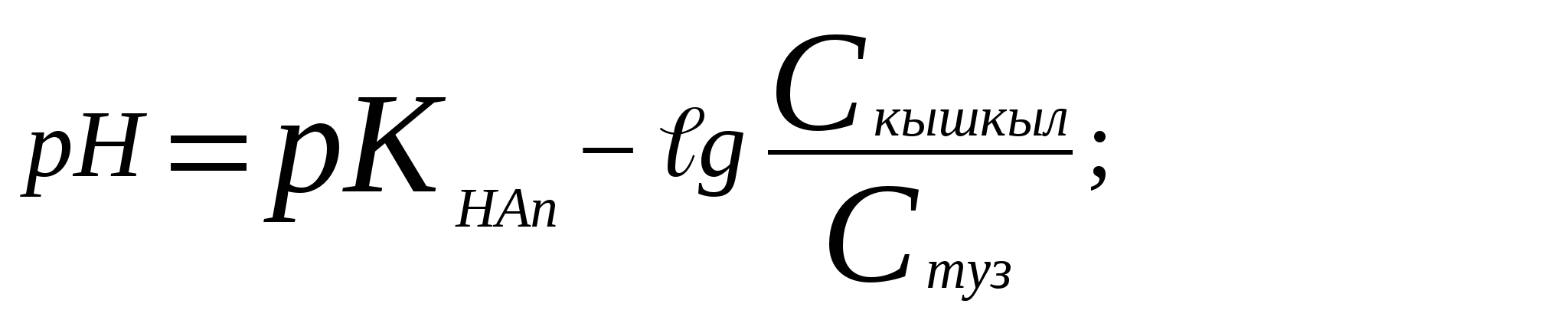
Негіздік жүйелер үшін:
ВН+ + Н2О → ВН+ + ОН-
NH4OH ↔ NH4+ + OH-
NH4CI ↔ NH4+ + CI-
 ;
; 
[B] = Снегіз; [BН+] = Стұз
 ;
; 
Буферлі сыйымдылық
Буфферлі қоспаның буферлік сыйымдылығы деп – рН – ты 1 санға өзөгертуге қажетті буферлі жүйенің 1 литріне қосылатын күшті қышқылдың (негіздің) эквиваленттік моль санын айтады.
Мысалы: (CH3COOH + CH3COONa) үшін

13. Тотығу-тотықсыздану реакциялары.Тотығу-тотықсыздану потенциалы. Нернст теңдеуі. Тотығу-тотықсыздану реакцияларының тепе-теңдік константалары.
Тотығу-тотықсыздану реакциялары (ТТР) - реакцияға қатысушы заттардың құрамындағы элементтердің тотығу дәрежелерінің өзгеруімен жүретін реакциялар.[1]
18 ғасырдың аяғында А.Лавуазье жанудың оттекті теориясын ұсынған кезден бастап тотығу заттардың оттекпен қосылуы, ал тотықсыздану оттекті бөліп алу процестері деп қаралған. 1920 – 1930 ж. химияда электрондық түсініктің қалыптасуына байланысты оттек қа-тыспайтын реакциялардың да Тотығу-тотықсыздану реакциялар болатындығы анықталды. Тотығу-тотықсыздану реакциялар процестері көбінесе электрондық теңдеулермен өрнектеледі. Зарядтардың сақталу заңына қайшы келмес үшін Тотығу-тотықсыздану реакциялар кезінде тотықтырғыштың қосып алған электрондар саны тотықсыздандырғыштың берген электрондар санына тең болуы керек деген жалпы ереже сақталады. Тотығу-тотықсыздану реакцияларын коэффиценттер қойып теңестірудің екі әдісі бар: электрондық тепе-теңдік және электрон-ион. Электрондық тепе-теңдік әдісі бойынша берілген және қосып алған электрондар саны элементтердің реакцияға дейінгі және реакциядан кейінгі тотығу дәрежесінің негізінде анықталады. Реакция барысында электрондарын беретін атомдар, иондар және молекулалар тотықсыздандырғыш, ал электрондарды қосып алатын бөлшектер тотықтырғыш болып есептеледі.
Реакция барысында электрондардың берілуі тотығуға, ал электрондардың қосып алынуы тотықсыздануға жатады. Сол себепті тотығу-тотықсыздану реакцияларының нәтижесінде тотықсыздандырғыш электрондарын беріп, тотығады, ал тотықтырғыш электрондарды қосып алып, тотықсызданады. Тотығу-тотықсыздану реакциялары үшке бөлінеді: молекулааралық, молекулаішілік, диспропорция.
Тотығу-тотықсыздану реакцияларының бағытын болжау үшін, электродтық немесе тотығу-тотықсыздану потенциалының шамасымен сипатталатын, тотығу-тотықсыздану жүйесінің салыстырмалы күшін білу керек.
Тотықтырғыш пен тотықсыздандырғыш анықтап алу керек. Ол үшін типті тотықтырғыш пен тотықсыздандырғыштың тізімін пайдалану керек.
2) Реакциядан кейін тотықтырғыш пен тотықсыздандырғыш қандай тотығу дәрежелеріне ие болатынын анықтау керек. Реакцияға неғұрлым күшті тотықтырғыш қатысса, соғұрлым тотықсыздандырғыштың тотығу дәрежесі өседі. Мысалы, H2S әлсіз тотықтырғыштың әсерінен S0(S-2→ S0)-ке айналады, ал күшті тотықтырғыш әсер етсе, H2SO4-ке (S-2→ S+6) айналады.
Осыған ұқсас неғұрлым күшті тотықсыздандырғыш тотықтырғышпен әрекеттесе, соғұрлым тотықтырғыштың тотығу дәрежесі төмендейді.
Мысалы, H2SO4 әлсіз тотықсыздандырғыш әсерінен SO2-ге (S+6→ S+4), ал күшті тотықсыздандырғыш әсерінен H2S-ке (S+6→ S-2) айналады.
3) Берілген ортада (қышқыл, сілтілі және бейтарап) тотыққан және тотықсызданған элементтер қандай қосылыс күйінде болатынын анықтайды. Мысалы, Fe+3 қышқыл ортада Fe(III) тұзы күйінде, ал сілтілі ортада Fe(OH)3 күйінде болады.
Дата добавления: 2015-09-07; просмотров: 299 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Схема развития конфликта и вероятность выхода из конфликтной ситуации | | | ТТР теңдеуіндегі коэффициенттер электрондық және электронды-иондық баланс арқылы анықталады. |