
Читайте также:
|
Тотықтырғыш және тотықсыздандырғыштың күйі, табиғаты, концентрациясы
 ;
;  .
.
2. Комплексті қосылыстардың ерітіндідегі химиялық тепе-теңдігі, комплекс түзушінің координациялық саны, лигандтардың дентаттылығы, тұрақтылық, тұрақсыздық константалары
Жай қосылыстарды, иондарды және молекулалық топтарды жолымен алынған қосылыстар комплексті нсмесе координациялық қосылыстарға жатады. Комплексті қосылыстарда орталық орынды комплскс тузуші алады, ол одетте атом жөне зарядталған ион (олар кобінесе металдар) болады. Комплексті қосылыстарды көбінесе Д.И.Менделеевтің периодтық жуйесіндегі сі-элементтер тузеді. Осы элсменттердің катиондарының 8 ден 18 дсйін электрондары болады, олар комплексті иоңдар тузс аниондар мен полюсті молекулаларды поляризациялайды.
Бүлар Ае+, Аи+, Си2+, Нё2+, Ссі2+, 2п2+, Ғс2+, Ғе3+, Со3+, №2+, Сг3+, Рі4+ жөне басқалары. Дегенмен, басқа элементтсрдің де катиоңдары бслгілі бір жағдайларда комплекс түзугс бейім.
Комплекс түзушінің айналасындағы болшектер (иондар немссе молекулалар) лигандгар деп аталады Әдеттс лигандтардың ролін аниондар женс полюсті молекулалар атқарады. Кез-келген жагдайда олардың ең кемінде бір бөлінбеген валснтті электрон жүбы болады.
Мысалы, И20, 1ЧН3, N0, СО, С1\ Вг\ Г, ОН\ С032\ 52032\ СК" жөне т.б. Комплекс түзуші жоне лигандтар комплекеті қосылыстардың ішкі сфсрасын қүрайды. Ішкі сфераға кірмей қалған жәнс комплскс тузушіден алшақ орналасқан иондар комплсксті қосьшыстың сыртқы сферасын қүрайды. Сыртқы сферада кобінесе сілтілік жөне сілтілік жер металдардың, аммонийдін жөне т.б. иондары болады. Кейбір комплексті қосылыстардын сыртқы сферасы болмайды. Олардағы ішкі сфсраға кіретіи иондардың теріс заряды комплекс түзушінің оң зарядына тең. Комплексті қосьшыстардың формуласын жазарда комплекс түзуші мен лиганд, яғни ішкі сфераны тік жақшаға алып жазады. Бүл ерітінділсрде комплексті ион оны қурайтын иовдарға жәнс молскулаларға диссоциацияланбайтынын көрсетеді. Комплексті ион заряды комплекс тузуші мен лигандтардың алгебралық косындысына тең.
Комплексті қосылыстар диссоциацияланғанда оМплексті иопдар түзеді, мысалы: [Аё(*Нз)2]С1«[А&(>Щз)2]++СГ.
Мүндай диссоцация әдетте толығымсн жүрсді. Комплсксті иондар оз кезегінде екіншілікті диссоциацияға үіхіырайды: гАе(№з)2]+«Аё++2МН3-.
Бүл диссоциациялану әдстте, аз мөлшерде жүреді. Әрскеттссуші массалар зацын пайдаланып, комплексті иондардыц түрақсыздық константасының мөнін табуға болады:
[АГ]-[НН3]2=6>8,108
|А8(ЫНз)г1 [Аё(^Н3)2] +
Комплексті ионның түрақсыздық константасы ішкі сфсрадағы комплексті қосылыстардың түрақтылығын көрсстеді. Ксйбір комплсксті иондардың түрақсыздық константасының мәні қосымшадағы кестсдс бсрілгсн.
Комплсксті ионның диссоциациясы қайтымды процссс болғандықтан, сферағы ионды байланыстырып, комплсксті бүзуға болады. Мысал ретінде НгЮз-тің [А§(Г»Шз)2]С1 орекетгесуін қарастырамыз.
[Ае(МН3)2]С1+НМ03 =АвСі4.+2>Щ4М03.
Комплекстің бүзылуы, түрақсыздық константасының мөні кіші кейбір түрақты комплекс түзілгсндс де іскс асады.
Комплексті қосылыстардың қосылыс боліктерінің кеңістікте орналасуы қүрамындағы молекула түгелімен езгермей бүзылуы жиі кездеседі. Мысалы, СгС13-6Н20 Қосылысына үш түрлі зат сөйкес келеді. Күлгін түздың молеқуласындағы, барлық алты су молекуласы ішкі сферада болады [Сг(Н20)б ]С13. Қыздырғанда су молекуласының бір бөлігі ішкі сферадан шығып кетсді де, орнына хлорид иондары келс бастайды, сойтіп [Сг(Н20)5 С1]С12-Н20 - ашық-Жасыл түсті, [Сг(Н20)4 С1]С1-2Н20-қою-жасыл түсті Изомерлер түзіледі.
СгС13-6Н20 қосьшысындағы изомерия гидраттық Изомерия деп аталады. Комплексті қосьшыстарда, жоғарьща Көрсстілгендей басқа да изомерия түрлері байқалады.
Аноганикалық қосылыстардың ішінде валенттілік бойынша түзілген қосылыстармен қатар, валенттілікке бағынбай түзілетіндері де көптеп кездеседі. Алғашқылардың бірінші қатарындағы, ал соңғыларды жоғарғы қатардағы қосылыстар деп айтады. Осы жоғары қатардағы қосылыстарға қос тұздар және комплексті қосылыстар жатады. Қос түздар суда еріген кезде түгеддей иондарға ыдырайды:

Ал комплекс түздар суда ерігенде комплексті иондар түзеді:

Мүнда [Ғе(С1Ч)6]4~ ионы судағы ерітіндіде жөне қатты кристалл күйінде де бола алады. Осындай иондарды комплексті иондар дейді. Комплексті иоңдар күрамына иондармен қатар, бейтарап молекулалар да кіреді [А§(гШ3)2]+.
Алғаш комплекс қосылыстар түзілу механизмін швейцария химигі А. Вернер үсынды. Ол негізгі жене қосымша валенттілік үғымын енгізді. Мысалы, КДН&Ғ^] комплекс косылысының түзілуін А. Вернер былай түсшдірді: сынап бүл қосылыста екі валентті, оған негізгі валенттілік бойынша екі иод ионы I-байланысады, ал қалған екі йод ионы 3~ сынаппен қосымша валенттілік арқылы байланысады. Ол негізгі валенттілікті сызықшамен, қосымша валенттілікті үзік сызықпен белгілеуді үсынды. Сонда КДН&у қосылысының қүрылысын былай кврсетеді:
Гле:: 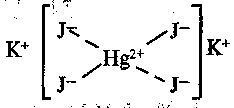
Мүнда сьшап пен йод иоңцары комплекстің ішкі сферасьш, ал К+иоңдары сыртқы сфера түзеді. Басқа да комплекс түздар осылай қүрылған.
А. Вернер координациялық теориясын үсынған кезде (1893 х.) өлі атом қүрьшысы теориясы ашьшмаған еді. Сондықтан ол үсынған теория негізгі және қосымша валенттіліктің мәнін түсіңціре алмады.
Қазір атом қүрылысы теориясы түрғысынан негізгі және қосымша валенттілік мөні толық анықтадды. Негізгі валенттілік ионды немесе ковалентті байланыс, ал қосымша валенттілік — ковалентті байланыстың бір түрі — донорлық-акцепторлық механизм арқьглы түзіледі. Донорлық-акцепторльгқ механизм арқылы ковалентті байланыс түзілу үшін бір элемент атомьшың бос орбиталі, ал басқа атомның байланыс түзуге қатыспаған жүп электроны болуы тиіс. Жүп электроны бар атом электрондарын бос орбиталі бар атомға беріп байланысады. Сонымен, комплексті қосылыстарға мынадай анықтама беруге і бодады:
Қурамында донорлық-ащепторлық механизм арқылы ең кемінде бір байланыс бар қосылыстарды комплексті қосылыстар дейді.
3. Аналитикалық химиядағы комплекс түзу реакцияларының сапалық талдауда қолданылуы.
4. Аниондардың әртүрлі қасиеттеріне қарай жіктеліну түрлері. І-ІІІ топ аниондары
Аз еритін барий және күміс тұздарының түзілуіне байланысты аниондардың жіктелуі
| Реагент | Аниондар | Ерігіштігі |
| AgNO3 (BaCl2 –мен әрекеттеспейді) | Cl-, Br-, J-, CNS-, CN-, [Fe(CN6)]4-, [Fe(CN6)]3- | HNO3 ерімейді |
| S2-, Ac-, NO2- (концентрлі ерітіндіден) | HNO3 ериді | |
| BaCl2 (AgNO3 –пен тұнбасы ақ түсті) | SO42-, CO32-, SO32-, C2O42-, C4H4O62-, BO33- | HСl ериді (ВаSO4 басқасы) |
| BaCl2 (AgNO3 –пен тұнбасы түсті) | PO43-, AsO43-, AsO33-, CrO42-, Cr2O72-, S2O32- | HNO3 ериді |
| AgNO3 және BaCl2 тұнба түзілмейді | NO3-, ClO3-, MnO4-, ClO- (аниондар жарықта Cl- ионы бөліну нәтижесінде ерітіндіде AgCl ақ тұнбасы түзілуі мүмкін) |
Осылайша, H2SO4сұыт, H2SO4конц, KJ + 1М H2SO4 + крахмал, J2 + крахмал, KMnO4 + H2SO4, AgNO3 және BaCl2 реактивтерін қолдана отырып алдын-ала сынақ жүргізу арқылы зерттелетін
ерітіндіден аниондардың бір бөлшегін анықтауға болады.
5. Гетерогенді тепе-теңдік. Аналитикалық химияда нашар еритін қосылыстар тұнбалары. Ерігіштік көбейтіндісі және иондық көбейткіш.
Кез келген аз еритін заттың біраз мөлшері ерітіндіге өтіп отырады. Ерітіндіге еріген зат иондар түрінде таралады. Бір кезде тұнбадағы зат пен ерітіндіге таралған иондар арасында жылжымалы тепе-теңдік орнайды. Мысал үшін AgCI қосылысын алсақ, ерітіндідегі тепе-теңдікті былай жазуға болады:
AgCI  Ag+ + CI-
Ag+ + CI-
Тұнба ерітінді
ЕКAgCI= [ Ag+] [CI-]
ЕКAgCI= [ Ag+] [CI-]
Мұнда, ЕКAgCI – күміс хлоридінің ерігіштік көбейтіндісі. Бұл теңдеуден ерігіштік көбейтіндісінің берілген температурада тұрақты екені көрініп тұр. Егер Ас Вm 
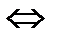 [A+] [B-] болса, онда ерігіштік көбейтіндісі мынаған тең болады:
[A+] [B-] болса, онда ерігіштік көбейтіндісі мынаған тең болады:
EK АсВь = [A+]c [B-]m.Ерігіштік көбейтіндісін ЕК табу үшін электролиттің ерігіштігін білу керек және керісінше, ерігіштік көбейтіндісі арқылы заттың ерігіштігін анықтауға болады. Ерігіштік көбейтіндісін ЕК заттың еру қабілетін сипаттайды, ЕК (ПР) жоғары болса, заттың ерігіштігі де жоғары
[ Ag+] [CI-] < ЕКAgCI – ерітінді қанықпаған
[ Ag+] [CI-] = ЕКAgCI – ерітінді қаныққан
[ Ag+] [CI-]> ЕКAgCI – ерітінді аса қаныққан
Ерігіштік көбейтіндісі - қаныққан ерітіндісіндегі аз еритін электролит иондарының концентрацияларының көбейтіндісіне тең. Ерігіштік пен ерігіштік көбейтіндісі арасындағы байланыс:
 . Мұндағы, m+n – катиондар мен аниондар қосындысы, m-катион ионының сан, n –анион молекуласының саны,
. Мұндағы, m+n – катиондар мен аниондар қосындысы, m-катион ионының сан, n –анион молекуласының саны,  ерігіштік көбейтіндісі,
ерігіштік көбейтіндісі,  ерігіштік.
ерігіштік.
Су қосқанда:

Катион қосқанда: 
Анион қосқанда: 
6. Ерігіштік және оның есептелуі. Тұнбаның еруіне әсер ететін факторлар.
Гетерогенді жүйе дегеніміз бірнеше фазадан құралатын жүйені айтамыз.Тұнба мен су ерітіндінің арасындағы тепе-теңдікті қарастырамыз.PbSO4 нашар еритін суға салатын болсақ аз мөлшерде ериді,бірақ еріген PbSO4 молекулалары бірден толық диссоциацияланады.Сол кезде тепе-теңдік орын алады.
↓ PbSO4→Pb2++ SO42- бұл тепе –теңдікті келесі тепе-теңдік константасы сипаттайды.

 иондардың тепе –теңдік концентрациясы
иондардың тепе –теңдік концентрациясы
 - заттың қатты фазадағы концентрациясы
- заттың қатты фазадағы концентрациясы
Демек тұнба көлемінің бір бірліктегі зат мөлшері.
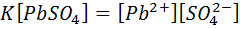
Мұнда қатты фазадағы  қатты концентрациясы тұрақты шама,себебі қатты фазадағы кез –келген заттың концентрациясы тұрақты шама.
қатты концентрациясы тұрақты шама,себебі қатты фазадағы кез –келген заттың концентрациясы тұрақты шама.


Осы соңғы теңдеу бойынша PbSO4 қанық ерітіндіде Pb және SO4 иондарының концентрациясы көбейтіндісі де тұрақты шама болды, бұл қорғасын сульфатының ерігіштік көбейтіндісі деп аталады.
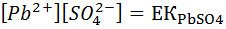
250 С PbSO4 ерігіштік көбейтіндісі  жалпы түрде ерігіштік көбейтінді осылай жазылады.
жалпы түрде ерігіштік көбейтінді осылай жазылады.
7. Сандық талдау, оның түрлері, қолданылу салалары. Гравиметриялық талдау, әдістің артықшылығы және кемшілігі.
Аналитикалық химияда сандық талдау 2 әдіске бөлінеді: Гравиметрлік және титриметрлік деп. Гравиметрлік талдау- тұнба түсу реакциясына негізделіп, анықталатын заттың массасын өлшеу арқылы анықталады. Гравиметрлік әдісте анықтайтын компонентті үлгіден газ түрінде шығарып та анықтайды, ол айдау әдісі болып табылады. Бұл әдісте не айдалған заттың массасын, не қалған қалдықтың массасын анықтайды. Гравиметрлік анализді жүргізу өте көп уақыт алады. Кез келген тұнбаны гравиметрлік анализде пайдалана беруге болмайды. Гравиметрияда қолданылатын тұнбалар белгілі шарттарға сәйкес болуы қажет, яғни тұнбаның ерігіштігі өте нашар болуы керек, тұнбаның құрылысын жеңіл филтрлеп және қоспалардан жеңіл жуатындай болуы керек, тұнбаның тұну формасы гравиметрлік түріне оңай және толық ауысуы керек.
Гравиметрлік әдіс ертеден белгілі әдіс, гравиметрлік әдісті 2 жолмен жүзеге асыруға болады: тура және жанама әдістер арқылы.
Тура гравиметрлік әдісті 2 түрлі нұсқамен жасауға болады: 1) анализденетін компоненттерді таза элемент күйінде бөліп өлшейді. Кез келген элементті таза күйінде алу қиын, сондықтан бұл әдісті сирек пайдаланады. 2) анықталатын компонентті белгілі қосылыс түрінде тұндырып өлшейді.
Жанама әдіс минерал құрамындағы суды анықтау үшін қолданылады. Мұнда зерттелінетін затты кептіргенге дейін және кептіргеннен кейін өлшейді. Сонда 2 массаның айырымы минаралдағы судың массасы тең болады. mсу=m1-m2
Аналитикалық химияда сандық талдауда осы жанама әдіс қолданылады.
8. Тұнбаға қойылатын талаптар. Тұнбаның тұндырылған күйі мен гравиметриялық түрлері. Мысал келтіріңіз. Тұнбаға әсер ететін факторлар
Тұнбаны кептірген кезде тұнба құрамының өзгеруі мүмкін сондықтан гравиметрлік талдауда 2 түрлі формалы қосылыстар болуы тиіс:тұндырылған және гравиметрлік. Көптеген жағдайда тұндырылған форма мен гравиметрлік форма бір-тіріне сәйкес келеді. (BaSO4, AgCI т.б.). Жиі тұнбаның тұндыру формасының құамы мен гравиметрлік формасының құрамында айырмашылық болады, мысалы: Mg2+ анықтағанда тұндыру формасы MgNH4PO4*6H2O, осы тұнбаны қыздырғанда Mg2P2O7 болып ауысады. Тұнба Mg2P2O7 түрінде өлшенеді. Тұндырылған формасы құрамына анықталатын компонент кіретін тұндырылған қосылыс.
Гравиметрлік форма құрамына анықталатын компонент кіретін өлшенетін қосылыс.Анықталатын компонент бір тұнба күйінде алынады одан кейін түзілген тұнбаны қыздырады оның нәтижесінде екінші қосылыс түзіледі оның массасын өлшейміз.Жалпы жағдайларда бұл екі форма әр түрлі.әдетте Т.Ф≠Г.Ф. Т.Ф қыздырған кезде Г.Ф ауысады.
Т.Ф қойылатын талаптар:
1.Анықталатын коипонент толық тұнбаға түсуі қажет.
2.Басқа иондармен тұнбаға түспеуі тиіс.
3.Тұндырылған форма оңай Гравиметрлік форма ауыса алатын болу керек.
4.Тұндырылған форма оңай сүзілуі қажет, сондықтан тұнбаның аморфты формасынан гөрі кристалдық формасы жайлы болып келеді.
Гравиметрлік формаға қойылатын талаптар:
1.Г.Ф-ң құрамы оны химиялық формасына дәл сәйкес болуы қажет.
2.Г.Ф ауаның әсеріне төзімді болуы қажет.
3.Г.Ф-дағы анықталатын компненттің мөлшері ең аз болуы тиіс.
9. Титриметриялық талдау, оның түрлері. Титриметриялық талдауда қолданылатын реакцияларға қойылатын талаптар. Аналитикалық талдауда жиі қолданылатын ерітінді концентрацияларының есептеу жолдары
Титриметриялық талдау – зерттелетін қосылысқа кеткен ерітіндінің көлеміне негізделген сапалық талдаудың түрі. Бұл әдісті басқаша жанама әдіс деп те атайды. Титрлеу дегеніміз – ерітіндінің титрі анықталып, сол ерітіндіні белгісіз қосылысқа аналитикалық сигнал алынғанша қосу процесі. Титр – 1мл ерітіндідегі еріген заттың грамм немесе миллиграмм мөлшері. Титрлейтін ерітінді титрант деп аталады. Титриметриялық әдістің ерекшелігі:
· Тез жүреді
· Зерттелетін ерітінді мен реагент эквивалентті қосылады.
Дата добавления: 2015-09-07; просмотров: 932 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ТТР теңдеуіндегі коэффициенттер электрондық және электронды-иондық баланс арқылы анықталады. | | | Титриметриялық талдаудың жіктелуі. |