
Читайте также:
|
Каждое вещество может находиться в четырех агрегатных состояниях: твердом, жидком, газообразном и плазменном. Переход из одного агрегатного состояния в другое называется фазовым превращением.
Кристаллизацией называется процесс образования кристаллов (кристаллической решетки) из жидкой или газообразной среды. В природе все самопроизвольно протекающие процессы, в том числе плавление и кристаллизация вызываются тем, что новое состояние в новых условиях является более устойчивым и обладает меньшим запасом свободной энергии. Под свободной энергией F - понимают ту часть внутренней энергии, которая может быть превращена в работу. С повышением температуры свободная энергия жидкого и твердого состояния уменьшается. Однако она меняется различно для жидкого и твердого состояния (рис.1.4.). При температуре выше T0 меньшей свободной
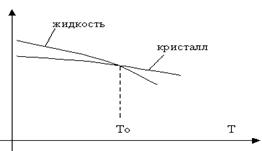
Рис. 1.4. Свободная энергия F
энергией обладает вещество в жидком состоянии, ниже T0 - в твердом состоянии. Следовательно, при T> T0 вещество находится в жидком состоянии, а при T<T0 – в твердом состоянии. Очевидно, что при T0 свободные энергии жидкого и твердого состояния равны, металл в обоих состояниях находится в равновесии.
Температура T0 называется равновесной или теоретической температурой кристаллизацией ( плавления).
При T0 не может происходить процесс кристаллизации, т.к. для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден, т.е. необходимо создать такие условия, при которых свободная энергия твердой фазы будет меньше, чем свободная энергия жидкой фазы. Как видно из рисунка 1.4., это возможно лишь при некотором переохлаждении сплава. Температура, при которой практически начинается кристаллизация, называется фактической температурой кристаллизации. Степенью переохлаждения ∆T называется разность между равновесной (теоретической) и фактической температурами кристаллизации
∆T= T0-Tкр , где T0 – равновесная температура, Tкр – фактическая температура кристаллизации.
Для развития процесса кристаллизации необходима некоторая степень переохлаждения ∆ T. Движущей силой любого превращения является разность свободных энергий, зависящая от скорости охлаждения.
∆F=Fж-Fкр
Процесс кристаллизации изучают по кривым охлаждения (рис. 1.5).
Температура

Рис. 1.5. Кривые охлаждения при кристаллизации
Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры (участок AB).Скорость охлаждения (наклон кривой) зависит от разности температур металла и охлаждающей среды. При достижении температуры кристаллизации на кривой появляется площадка (участок BC), т.к. отвод тепла компенсируется так называемой открытой теплотой кристаллизации. По окончании кристаллизации (точка C), т.е. когда весь жидкий металл перейдет в кристаллическое состояние, температура опять начинает снижаться, происходит охлаждение затвердевшего металла (участок CD). Чем больше скорость охлаждения, тем при низкой температуре заканчивается процесс кристаллизации и тем больше будет степень переохлаждения.
Процесс кристаллизации состоит из двух элементарных процессов:
· зарождение центров кристаллизации или зародышей;
· рост кристаллов из этих центров.
На рис.1.6. дана модель процесса кристаллизации.
Рис. 1.6. Качественная схема процесса кристаллизации 
Каждую секунду появляется какое-то количество новых центров кристаллизации, в то же время появившиеся ранее зародыши подрастают с определенной скоростью на какую-то величину. Столкновение растущих кристаллов приводит к потере ими правильной огранки. Это уже не кристаллы, а зерна.
Общая скорость процесса кристаллизации (рис.1.7.) складывается из скорости элементарных процессов и зависит от степени переохлаждения (или скорости охлаждения расплава): ч.ц. – число центров кристаллизации, возникших за 1 с в 1 мм3 расплава, с.р. – линейная скорость роста кристалла, мм/c.

Рис.1.7. Скорость кристаллизации
При медленном охлаждении V1 и малой степени переохлаждения ΔT1 возникает малое число зародышей в единицу времени. Из них небольшое количество крупных зерен. В этом случае получается крупнозернистая структура металла.
При большой скорости охлаждения V2 и значительной степени переохлаждения ΔT2 возникает множество зародышей в единицу времени, и из них вырастает много мелких зерен. Структура получается мелкозернистая.
Таким образом, практически увеличение скорости охлаждения при кристаллизации приводит к формированию более мелкозернистого металла, имеющего более высокие механические свойства.
Очень маленькая скорость охлаждения может привести к получению только одного зародыша, из которого можно вырастить монокристалл.
Дата добавления: 2015-09-05; просмотров: 200 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Типы кристаллических решеток | | | Строение слитка |