
Читайте также:
|
Ферменти, як було встановлено ще у 1922 р., є білками. Їхня роль унікальна: вони збільшують швидкість перебігу хімічної реакції, але при цьому не використовуються. У 1926 р. був вперше очищений і виділений фермент уреаза, що каталізує реакції розщеплення сечовини до аміаку і діоксиду вуглецю. До сьогодні у кристалічному вигляді отримані сотні різних ферментів, розшифровані їхні амінокислотні послідовності, вивчається їхня роль у метаболічних перетвореннях.
У ролі біокаталізаторів можуть виступати і небілкові сполуки. Наприклад, деякі типи РНК викликають гідроліз фосфодиефірних зв’язків нуклеїнових кислот. Такі молекули РНК з каталітичною активністю називають рибозимами, однак їхній вклад у хімічне перетворення сполук є набагато меншим, ніж ферментів.
Оскільки ферменти – білкові молекули, їм притаманні усі властивості, що характерні для білків. В той же час вони мають особливості будови, що характеризують їх як каталізатори. Розглянемо основні властивості ферментів як біологічних каталізаторів.
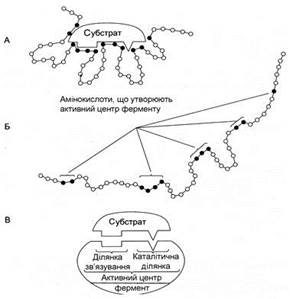
Біологічна функція ферменту як і будь-якого білка, обумовлена наявністю в його структурі активного центру. Ліганд, що взаємодіє з активним центром ферменту, називають субстратом. У активному центрі ферменту є амінокислотні залишки, функціональні групи яких забезпечують зв’язування субстрату, і амінокислотні залишки, функціональні групи яких здійснюють хімічне перетворення субстрату. Умовно ці групи позначають як ділянку зв’язування субстрату і каталітичну ділянку, але потрібно пам’ятати, що не завжди ці ділянки мають чітке просторове розмежування, іноді вони можуть «перекриватися».
В ділянці зв’язування субстрат за допомогою нековалентних зв’язків взаємодіє (зв’язується) з ферментом, формуючи ферментсубстратний комплекс. У каталітичній ділянці субстрат піддається хімічному перетворенню на продукт, який потім вивільнюється з активного центру ферменту. Схематично процес каталізу можна представити наступним рівнянням:
E + S ↔ ES ↔ EP ↔ E + P,
де Е – фермент (ензим), S – субстрат, Р – продукт. Наведені позначення є загальноприйнятими і походять від англійських слів enzyme,substrat,product.
Дата добавления: 2015-08-21; просмотров: 137 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Характеристика первинної,вторинної,третинної та четвертинної структур білків. | | | Класифікація та біологічне значення вітамінів. Хвороби вітамінної недостатності. |