
Читайте также:
|
Концентраций растворов обычно выражают в массовых (весовых) и объемных (для жидкостей) процентах, в м.олях или граммэквивалентах, содержащихся в единице объема раствора, а также титром и молялностью (молон - моль/кг).
Концентрации приблизительных растворов большей частью выражают в массовых процентах; точные - в молях, в грамм-эквивалентах, содержащихся в 1л раствора, или титром.
При выражении концентрации в.массовых процентах указывают содержание растворен-ного вещества (в граммах) в 100г раствора (но не в 100 мл раствора).
Так, если говорят, например, что взят 10%-ный раствор поваренной соли (NaCI), это значит, что в 100г раствора (а не в 100мл его) содержится 10г поваренной соли и 90г воды.
Если известна плотность раствора, то, как указывалось выше, удобнее брать его по объему, а не по массе, причем для вычисления нужного объема можно пользоваться фор-мулой:
M (масса) 20
V (объем) = -------------- = ---------- = 16,6 мл.
 P (плотность) 1,203
P (плотность) 1,203
Это относится преимущественно к концентрированным растворам; в случае же разбавленных (меньше 1 %) получающаяся ошибка незначительна и ею можно пренебречь.
Концентрация раствора, выраженная в молях, содержащихся в 1л раствора (но не в 1л растворителя) называется молярностью. Раствор, содержащийся в lл 1 моль растворенного вещества, называется одномолярным или просто молярным. Молем (грамм-молекулой) какого-либо вещества называют молекулярную массу (молекулярный вес) его, выраженную в граммах; 0,001 моль называют миллuмолем, этой величиной пользуются для выражения концентрации при некоторых исследованиях.
Пример. Моль серной кислоты равен 98,08г, поэтому молярный раствор ее должен содер-жать это количество в lл раствора (но не в lл воды).
Если концентрация выражена числом грамм-эквивалентов, содержащихся в lл раствора, то такое выражение концентрации назыветсяя нормалЫiОстью. Раствор, содержащий в 1 л один грамм-эквивалент вещества, называется однонормальным или часто просто нор-мальным (н.).
Грамм-эквивалентом вещества является такое количество его, выраженное в граммах, которое в данной реакции соединяется, вытесняет или эквивалентно 1,008г водорода (т.е. 1 г-атом). Граммэквивалент одного и того же вещества может иметь различную величину в зависимости от той химической реакции, в которой это вещество участвует.
Грамм-эквивалент (Е) в реакциях замещения вычисляют путем деления молекулярной массы на основность кислоты или полученной из нее соли, кислотность основания или при окислительно-восстановительных реакциях-на число переходящих электронов (п):
M М
Е = -----------, для реакции замещения и Е = -----------, для окислительно – востанови -
Н n
тельных реакций, где:
М - молекулярная масса;
n - число переходящих электронов;
Н - основность кислоты или кислотность основания.
Ввиду того, что нормальные растворы для большинства аналитических целей и работ слишком концентрированы, обычно готовят более разбавленные растворы (0.5н., 0,1н.и т. д.). При записях нормальность обозначают русской буквой н. или латинской буквой N; перед буквенным обозначением ставят число, указываюшее, какая часть грамм-эквивалента (или сколько граммэквивалентов) взята для приготовления 1 л раствора. Так, полунормальный раств робозначается 0,5 н., децинормальный - 0,1 н. и т. д.
Титром называют содержание вещества в граммах в 1 мл раствора. Выражая концен-трацию раствора при помощи титра, указывают число граммов вещества, содержащихся в 1 мл раствора. Пусть, например, в lл раствора содержится 5,843г серной кислоты;
тогда титр раствора будет равен: 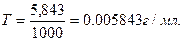
Моляльными называют растворы, приготовляемые растворением одного (или части) моля вещества в 1 кг растворителя. Например, для приготовления одномоляльного раствора NaCl растворяют 58,457г этой соли в 1 кг воды, приведя массу воды в данных условиях к объему. Следует помнить, что при приготовлении моляльных растворов расчет ведут именно на 1 кг растворителя, а не раствора, как в случае молярных или нормадьных растворов.
Объемные проценты для выражения концентрации применяют только при смешивании взаимно растворяющихся жидкостей.
Здесь указаны только основные, важнейшие приемы выражения концентраций. При специальных исследованиях могут применяться и другие единицы для выражения содер-жания вещества.
Контрольные вопросы
1) Что такое раствор?
2) Основные требования к растворам?
3) Методы определния концентрации растворов?
Дата добавления: 2015-10-26; просмотров: 173 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Направления применения лабораторных животных | | | Metrological certification of MI |