
Читайте также:
|
Типичный кислотный оксид. N2O5 легко летуч и крайне неустойчив. Разложение происходит со взрывом, чаще всего — без видимых причин:

Растворяется в воде с образованием азотной кислоты (обратимая реакция):

Растворяется в щелочах с образованием нитратов:

Азотистая к-та и нитриты
Физические св-ва:
Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, хорошо р-римы в воде, все они токсичны.
Азотистая к-та в свободном виде не существует

Химические св-ва HNO2:
Получение
Азотистую кислоту можно получить при растворении оксида азота (III) N2O3 в воде:

Также она получается при растворении в воде оксида азота (IV) NO2:

Восстановительные:
При действии более сильных окислителей (пероксид водорода, хлор) окисляется в азотную кислоту:


HNO2+2KMnO4+2H2SO4=5HNO3+2MnSO4+3H2O
Окислительные:
В то же время она способна окислять вещества, обладающие восстановительными свойствами:

2HNO2+2KI+H2SO4=2NO+I2+K2SO4+2H2O
Хмические св-ва нитритов:
Получение:
NO + NO2 + 2NaOH = 2NaNO2 + Н2О

Окислительные
2KNO2 + 2H2SO4 (разб.) + 2KI = 2NO↑ + I2↓ + 2H2O + 2K2SO4
Восстановительные:
5KNO2 + 3H2SO4 (разб.) + 2KMnO4 = 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
Азотная к-та
Азо́тная кислота́ (HNO3), — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации: моноклинной и ромбической решётками.
 -моноклинная
-моноклинная  -ромбическая
-ромбическая
Азот в азотной кислоте четырёхвалентен, степень окисления +5. Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C с частичным разложением. Растворимость азотной кислоты в воде не ограничена. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см, Tкип = 120,7 °C)
При кристаллизации из водных растворов азотная кислота образует кристаллогидраты:
моногидрат HNO3·H2O, Tпл = −37,62 °C
тригидрат HNO3·3H2O, Tпл = −18,47 °C
Твёрдая азотная кислота образует две кристаллические модификации:
моноклинная, пространственная группа P 21/a, a = 1,623 нм, b = 0,857 нм, c = 0,631, β = 90°, Z = 16;
ромбическая
Строение молекулы:

Получение:
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой:



Химические св-ва:
ВОДОРОД НЕ ВЫДЕЛЯЕТСЯ!!!!!!
Сильный окислитель.
| концентрированная | NO2 | |
| HNO3 | разбавленная | NO |
| сильно разбавленная | NH4+ |
Примеры:
Zn+4HNO3(конц)=Zn(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(разб.)=3Cu(NO3)2+2NO↑+4H2O (Zn-получится N2O, т.к. он более активный металл)
4Zn+10HNO3(оч. разб.)=4Zn(NO3)2+NH4NO3+3H2
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3

Разбавленная HNO3

б) с металлами, стоящими в ряду напряжений левее водорода:





Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:

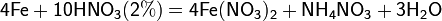
Реакции с различными классами
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:

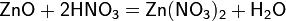
б) с основаниями:

в) вытесняет слабые кислоты из их солей:

При кипении или под действием света азотная кислота частично разлагается:

Азотная кислота окисляет неметаллы до высших оксидов и кислот, при этом азот обычно восстанавливается до NO или NO2:




C + 4HNO3 (конц., гор.) = CO2↑ + 4NO2↑ + 2H2O
As + 5HNO3(конц.) = H3AsO4 + 5NO2 + H2O
йод не до высшей ст.о.:
I2 + 10HNO3 (конц., гор.) = 2HIO3 + 10NO2↑ + 4H2O
и сложные вещества, например:

Оксид азота (+5) при взаимодействии со 100%-ным пероксидом водорода образует пероксоазотную (надазотную) кислоту:
N2О5 + 2Н2О2 = 2НNО4 + Н2О
Пероксоазотная кислота нестойка, легко взрывается, водой полностью гидролизуется:
HNO4+ Н2О = Н2О2 + НNО3
Нитраты
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
Химические св-ва:
Разложение
Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:

б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:

в) нитраты металлов, расположенных в ряду напряжений правее ртути:

г) нитрат аммония:

Окислительные св-ва:
Нитраты в водных растворах практически не проявляют окислительных свойств. Восстановить трудно. Единственная реакция-металл в кислоте или в щёлочи:
Zn+KNO3+HCl=ZnCl2+NH4Cl+KCl+H2O
Zn+KNO3+KOH+H2O=NH3+K[Zn(OH)4-качественная реакция. Выделяется аммиак
Гидратированные нитраты отличаются от безводных тем, что в их кристаллич. структурах ион металла в большинстве случаев связан с молекулами воды, а не с ионом NO-3. Поэтому они лучше, чем безводные нитраты, раств. в воде, но хуже-в орг. р-рителях, более слабые окислители, инконгруэнтно плавятся в кристаллизац. воде в интервале 25-100°С. При нагр. гидратированных нитратов безводные нитраты, как правило, не образуются, а происходит термолиз с образованием гидроксонитратов и затем оксонитратов и оксидов металлов.
В твердом состоянии при высокой температуре являются сильными окислителями, например, при сплавлении твердых веществ:
KNO3+C=KNO2+CO2
KNO3+S=KNO2+SO2
KNO3+Pb=KNO2+PbO
KNO3+Cr2O3+KOH=KNO2+K2CrO4
Нитрозил- и Нитроний- катионы.
Нитрозил: NO+
Нитроний: NO2+
Дата добавления: 2015-10-31; просмотров: 128 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Жидкий аммиак | | | Сборнику присваиваются библиотечные индексы УДК, ББK и международный стандартный книжный номер (ISBN). |