
Читайте также:
|
Реакции с кислотами
Взаимодействуя с кислотами даёт соответствующие соли аммония:
 ( Нитра́т аммо́ния; аммиачная селитра)
( Нитра́т аммо́ния; аммиачная селитра)
NH3(г) + H2O + CO2(г) = NH4HCO3 (Гидрокарбонат аммония;разрыхлитель для теста)
NH3(г) +HCl(г)= NH4Cl(т) (Хлорид аммония, нашаты́рь)
2NH3+H2SO4=(NH4)2SO4 (Сульфат аммония)
Реакция с активными металлами:
Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
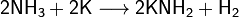
Восстановительные:
При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:


[комментарий к нижним реакциям]
2NH3 + 3CuO = 3Cu + N2 + 3H2O
NH3 + 3I2 = NI3 + 3HI
NH3 + Cl2 = NCl3 + NH4Cl (УРАВНЯТЬ)
Гидрат аммиака
Гидра́т аммиа́ка (гидрокси́д аммо́ния, аммиа́чная вода́, едкий аммоний, едкий аммиак) — соединение, образующееся при взаимодействии аммиака с водой и диссоциирующее в воде с образованием катионов аммония и гидроксид-анионов (слабое основание):
NH3 + H2O = NH3·H2O = NH4+ + OH−
Имеет щелочную среду
Реакция образования гидроксида аммония обратима, поэтому в водных растворах гидроксид аммония находится в равновесии с аммиаком, обусловливающим резкий запах таких растворов.
Водные растворы аммиака, в которых он существует преимущественно в форме гидроксида аммония, носят название аммиачная вода (промышленно выпускается 25%-й раствор аммиака, получают насыщением синтетическим газообразным аммиаком воды или аммиаком, образующимся при коксовании каменных углей в коксовых печах).
Применение
Аммиачная вода применяется для получения солей аммония (азотные удобрения), в производстве соды, красителей и др., слабый (обычно 10%-й) раствор — нашатырный спирт.
Дата добавления: 2015-10-31; просмотров: 53 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Способы получения | | | Жидкий аммиак |