
|
Читайте также: |
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявлется его сходство с водой:

Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов.
При испарении аммиака щелочные металлы выделяются в чистом виде
6NaNH2 = 6Na + 4NH3 + N2
а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6] обладающих металлической проводимостью.
[реакция]
При слабом нагревании эти комплексы разлагаются на металл и NH3.
[реакция]
Растворенный в NH3 металл постепенно реагирует с образованием амида:

Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Гидразин N-2
N2H4
Физические и хим.св-ва:
Бесцв. дымящая на воздухе жидкость с неприятным запахом. Вызывает рак и мужское бесплодие. Хорошо растворим в воде. Кривая молекула
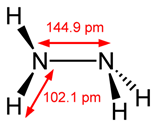
Способ получения:
Процесс Рашига. Гидразин получают окислением аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO:
NH3 + NaClO  NH2Cl + NaOH
NH2Cl + NaOH
NH2Cl + NH3  N2H4+ HCl,
N2H4+ HCl,
Химические с-ва и сравнение с аммиаком:
Термодинамически гидразин значительно менее устойчив, чем аммиак, так как связь N—N не очень прочна: разложение гидразина - экзотермическая реакция, протекающая в отсутствие катализаторов при 200-300 °С:
3N2H4 → 4NH3 + N2
горит:
N2H4+O2=N2+2H2O+Q
Переходные металлы (Co, Ni, Cu, Ag) катализируют разложение гидразина, при катализе платиной, родием и палладием основными продуктами разложения являются азот и водород:
N2H4 → N2 + 2H2
Благодаря наличию двух неподелённых пар электронов у атомов азота, гидразин способен к присоединению одного или двух ионов водорода. При присоединении одного протона получаются соединения гидразиния с зарядом 1+, двух протонов — гидразиния 2+, содержащие соответственно ионы N2H5+ и N2H62+. Водные растворы гидразина обладают основными свойствами, но его основность значительно меньше, чем у аммиака:
N2H4 + H2O → [N2H5]+ + OH− (Kb = 3,0·10−6)
(для аммиака Kb = 1,78·10−5) Протонирование второй неподеленной пары электронов протекает ещё труднее:
[N2H5]+ + H2O → [N2H6]2+ + OH− (Kb = 8,4·10−16)
Известны соли гидразина — хлорид гидразиния N2H5Cl, сульфат гидразиния N2H6SO4 и т. д. Иногда их формулы записывают N2H4 · HCl, N2H4 · H2SO4 и т. д. и называют гидрохлорид гидразина, сульфат гидразина и т. д. Большинство таких солей растворимо в воде.
Соли гидразина бесцветны, почти все хорошо растворимы в воде. К числу важнейших относится сульфат гидразина N2H4 · H2SO4.
Общ. сравнение:
1.менее основный
2.Одинаковые продукты горения
3.Два раза реагирует с к-тами
4.Легко горит
Ещё хим. св-ва:
Гидразин — энергичный восстановитель. В растворах гидразин обычно также окисляется до азота:
4KMnO4 + 5N2H4 + 6 H2SO4 → 5N2 + 4MnSO4 + 2K2SO4 + 16H2O
Восстановить гидразин до аммиака можно только сильными восстановителями, такими, как Sn2+, Ti3+, водородом в момент выделения(Zn + HCl):
N2H4 + Zn + 4HCl → 2NH4Cl + ZnCl2
Гидроксиламин N-1
NH2OH
Гидроксилами́н NH2OH — бесцветные кристаллы, легко растворимые в воде с образованием гидрата NH2ОН·Н2О.

Получение:
В лаборатории:
В лаборатории получают разложением в вакууме солей гидроксиламина: (NH3OH)3PO4 или [Mg(NH2OH)6](ClO4)2.
В промышленности
Действием на азотную кислоту атомарным водородом:

Химические св-ва:
-В водном растворе диссоциирует по основному типу, являясь слабым основанием:

-Подобно NH3, гидроксиламин реагирует с кислотами, образуя соли гидроксиламиния, например:

-На воздухе соединение является нестабильным:

но при давлении в 3 кПа (2,25 мм рт.ст.) плавится при 32 °С и кипит при 57 °С без разложения.
-На воздухе легко окисляется кислородом воздуха:

-Гидроксиламин проявляет свойства восстановителя, при действии на него окислителей выделяются N2 или N2O:

-В некоторых реакциях NH2OH проявляются окислительные свойства, при этом он восстанавливается до NH3 или NH4+, например:

Оксиды азота
N+1
Оксид азота(I) (закись азота, веселящий газ) — соединение с химической формулой N2O. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта.
Физические св-ва:
Бесцветный газ, тяжелее воздуха (относительная плотность 1,527), с характерным сладковатым запахом. Растворим в воде (0,6 объёма N2O в 1 объёме воды при 25 °C, или 0,15 г/100 мл воды при 15 °C), растворим также в этиловом спирте, эфире, серной кислоте. При 0 °C и давлении 30 атм, а также при комнатной температуре и давлении 40 атм сгущается в бесцветную жидкость. Из 1 кг жидкой закиси азота образуется 500 л газа. Молекула закиси азота имеет дипольный момент 0,166 Д. Закись азота является озоноразрушающим веществом, а также парниковым газом.

Получение:
Закись азота получают нагреванием сухого нитрата аммония. Разложение начинается при 170 °C и сопровождается выделением тепла. Поэтому, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, так как при температурах более 300 °C нитрат аммония разлагается со взрывом:

Более удобным способом является нагревание сульфаминовой кислоты с 73%-й азотной кислотой:

В химической промышленности закись азота является побочным продуктом и для её разрушения используют каталитические конвертеры, так как выделение в виде товарного продукта, как правило, экономически нецелесообразно.
NaNO2+Na=Na2N2O2+N2O
Химические св-ва:
Относится к несолеобразующим оксидам, с водой, с растворами щелочей и кислот не взаимодействует. Не воспламеняется, но поддерживает горение. Смеси с эфиром, циклопропаном, хлорэтилом в определённых концентрациях взрывоопасны. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя:


2N2O+S=SO2+2N2
CH4+4N2O=CO2+H2O+4N2
При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя:
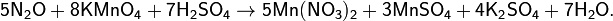
При нагревании N2O разлагается:
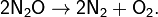
N+2
Физические св-ва:
Оксид азота(II) (окись азота) NO — несолеобразующий оксид азота. В нормальных условиях он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом, в жидком и твёрдом виде имеет голубой цвет. Ядовит. Редкий пример нечётной молекулы. Есть свободный радикал.

Получение:
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах (тепловой эффект реакции −180,9 кДж):

В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:

Более чистый, не загрязнённый примесями NO можно получить по реакциям:


Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):

Химические св-ва:
При комнатной температуре и атмосферном давлении происходит окисление NO кислородом воздуха:
 (бурый. Имеет отрицательный температурный коэф. скорости, т.е.при нагревании замедляется)
(бурый. Имеет отрицательный температурный коэф. скорости, т.е.при нагревании замедляется)
Механизм:
2NO=N2O2
N2O2+O2=N2O4
N2O4<=>2NO2
Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя с образованием нитрозилхлорида:

В присутствии более сильных восстановителей NO проявляет окислительные свойства:

C+2NO=CO2+N2
S+2NO=SO2+N2
В воде NO мало растворим и с ней не реагирует, являясь несолеобразующим оксидом.
N+3
Физические св-ва:
Оксид азота(III) (азотистый ангидрид) N2O3 — жидкость синего цвета (при н. у.), бесцветный газ (при стандартных условиях), в твёрдом виде — синеватого цвета. Устойчив только при температурах ниже −4 °C. Без примесей NO2 и NO существует только в твёрдом виде.

Получение:
Рекомендуется капать 50%-ю азотную кислоту на твёрдый оксид мышьяка(III):

N2O3 образуется при охлаждении получающейся смеси газов.
При пропускании электрического разряда через жидкий воздух N2O3 можно получить в виде порошка голубого цвета:



Химические св-ва:
Кислотный оксид. N2O3 подвержен термической диссоциации:
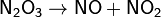
Являясь азотистым ангидридом, при взаимодействии с водой N2O3 даёт азотистую кислоту:

При взаимодействии с растворами щелочей образуются соответствующие нитриты:

С основным оксидом:
N2O3+CaO=Ca(NO2)2
N+4
Физические св-ва:
Оксид азота (IV) (диоксид азота, бурый газ, «лисий хвост») NO2 — газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.

В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона. При температуре 140 °C диоксид азота состоит только из молекул NO2, он очень тёмного, почти чёрного цвета. В точке кипения NO2 представляет собой желтоватую жидкость, содержащую около 0,1 % NO2. При температуре ниже 21°С — это бесцветная жидкость (или желтоватая из-за примеси мономера). При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4.
Получение:
В лаборатории NO2 обычно получают воздействием концентрированной азотной кислотой на медь:
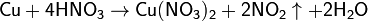
Также его можно получить термическим разложением нитрата свинца:

В промышленности и природе
2NO + O2 = 2NO2
Химические св-ва:
Кислотный оксид, ему соответствуют азотная и азотистая кислоты. NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами (фосфор, сера и углерод горят в нём). В этих реакциях NO2 — окислитель:


Окисляет SO2 в SO3 — на этой реакции основан нитрозный метод получения серной кислоты:

При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования):

Поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются HNO3 и NO:

Если растворение проводить в избытке кислорода, образуется только азотная кислота (NO2 проявляет свойства восстановителя):

При растворении NO2 в щелочах образуются как нитраты, так и нитриты:

Жидкий NO2 применяется для получения безводных нитратов:

N+5
Физические св-ва:
Оксид азота(V) (азотный ангидрид) N2O5 — бесцветные, очень летучие кристаллы. Крайне неустойчив и взрывоопасен. Токсичен.

Газообразный азотный ангидрид состоит из отдельных молекул, строение которых отвечает формуле O2N-О-NO2 и имеет неплоскую структуру. Кристаллы образованы ионами NO2+ и NO3−.
Получение:
Путём дегидратации азотной кислоты HNO3 с помощью P2O5:
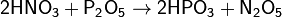
Путём взаимодействия оксида азота(IV) с озоном:
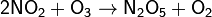
Дата добавления: 2015-10-31; просмотров: 181 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химические св-ва | | | Химические свойства |