
Читайте также:
|
V.1. Изохорный процесс (v = const).
Из общей формулы для абсолютной работы термодеформационной системы 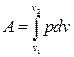 при dU=0 следует
при dU=0 следует
Av = 0 (160)
Изменение внутренней энергии из (148) определяется по формуле:
 (161)
(161)
Из первого начала термодинамики в обычной интегральной форме Q = DU + A для изохорного процесса получаем:
Qv = DUv (162)
или  (163)
(163)
Ранее для изохорного процесса была получена формула:

Этот же результат может быть получен из (154) при nv=±∞.
V.2. Изотермический процесс (T = const).
В формуле (143) при nT = 1 и p1v1 = p2v2 = RT = const получается неопределенность види {0/0}, которую нужно раскрывать специальным образом (например, по правилу Лопиталя). Проще найти абсолютную механическую работу в изотермическом процессе из общей формулы 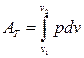 .
.
Из уравнения изотермического процеса
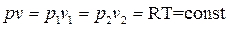 следует связь между p и v:
следует связь между p и v:  ,
,
откуда после подстановки в (163) и интегрирования получаем
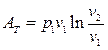 (164)
(164)
или
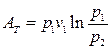 (165)
(165)
или
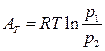 (166)
(166)
Внутренняя энергия идеального газа зависит только от температуры, поэтому при Т=const
DUT = 0 (167)
Этот же результат формально следует из (148).
Из первого начала термодинамики для изотермического процесса с учетом (167) получаем:
QT = AT (168)
Таким образом в изотермическом процессе вся подведенная к системе теплота идет на совершение системой абсолютной работы.
Из (154), (155) при n=1 получаются известные формулу для расчета изменения энтропии в изотермическом процессе:

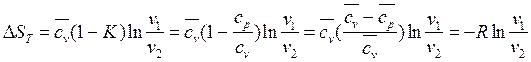
Здесь: R=cp-cv
cp/cv=K
Окончательно
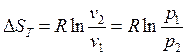 (169)
(169)
Формула (169) совпадает с полученной ранее.
V.3. Изобарный процесс (p = const)
Из общей формулы для удельной абсолютной деформационной работы в политропном процессе (143) при np=0 получим:
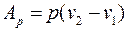 (170)
(170)
Из уравнения 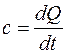 удельная теплота в изобарном процессе равна
удельная теплота в изобарном процессе равна  . При
. При 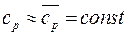 получим
получим
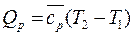 (171)
(171)
Ранее из первого начала термодинамики в энтальпийной форме было получено:
Qp = i2-i1 (формула (58))
Изменение внутренней энергии в изобарном процессе в соответствии с формулой (149) определяется как
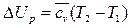 (172)
(172)
Из (154) получим:
 (173)
(173)
Формула (173) совпадает с полученной ранее.
V.4. Адиабатный процесс (dQ=0).
Как известно, обратимые адиабатные процессы являются изоэнтропными (S=const)
Из формулы (143) при ns = k, получаем:
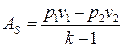 (174)
(174)
По аналогии с формулами (145) и (147), заменяя n на k, можно сразу записать:
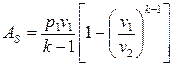 (175)
(175)
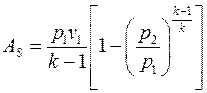 (176)
(176)
или
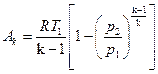 (177)
(177)
Из первого начала термодинамики в дифференциальной форме получим еще одну формулу для абсолютной работы в адиабатном процессе
dQ = dU + dA, откуда при dQ=0
dAS = - dUS (178)
или после интегрирования
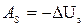 (179)
(179)
Из (149) изменение удельной внутренней энергии определяется по формуле:
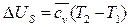 (180)
(180)
Подставляя (180) в (179) окончательно получим:
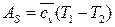 (181)
(181)
Дата добавления: 2015-09-01; просмотров: 85 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| IV.3. Изменение энтропии в политропном процессе. | | | Раздел VI. Второй закон термодинамики. |