
Читайте также:
|
Из физики известно четыре простейших процесса (изопроцесса):
1) изобарный;
2) изохорный;
3) адиабатный;
4) изотермический,
Для сравнения изобразим на рис.10 эти процессы, проходящими через общую точку А:
 |

 р 2
р 2
|
 |
|
|
 V
V
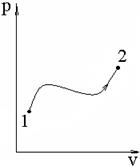
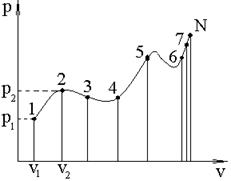
Но в целом ряде случаев реальные процессы, например рис.11, не соответствуют ни одному из изопроцессов.
Для выполнения теплотехнических расчётов в таких случаях, пусть даже с какими-то погрешностями, реальный процесс заменяется гипотетическим, имеющим формулу, удобную с точки зрения математических преобразований. Этому требованию удовлетворяет уравнение вида 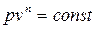 . Так как это уравнение должно описывать всё многообразие реальных процессов, то в этом уравнении должен присутствовать коэффициент согласования (идентификации). Этим коэффициентом является показатель степени n, называемый показателем политропы. Так как n - коэффициент согласования, то, в отличие от показателя адиабаты k в уравнении Пуассона
. Так как это уравнение должно описывать всё многообразие реальных процессов, то в этом уравнении должен присутствовать коэффициент согласования (идентификации). Этим коэффициентом является показатель степени n, называемый показателем политропы. Так как n - коэффициент согласования, то, в отличие от показателя адиабаты k в уравнении Пуассона 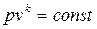 , где k>1, показатель политропы может иметь любые значения в интервале (-¥,+¥). Показатель политропы определяется только путем обработки опытных данных.
, где k>1, показатель политропы может иметь любые значения в интервале (-¥,+¥). Показатель политропы определяется только путем обработки опытных данных.
Алгоритм определения показателя политропы n.
1) Разбиваем pv-диаграмму реального процесса на N точек (чем больше точек, тем точнее n).
2) Снимаем с pv-диаграммы реального процесса значение давления pi удельного объёма vi в каждой i-той точке и заносим в таблицу.
3) Для каждой i-той точки вычисляем значения ln pi и ln vi и заносим в таблицу.
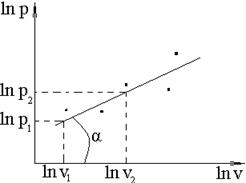
4) Перестраиваем pv-диаграмму в координатах: ln p - ln v.
5) Аппроксимируем точки на графике в логарифмических координатах одной прямой, используя метод наименьших квадратов или другой аналогичный метод. Если это удаётся без значительных погрешностей, то тангенс угла наклона прямой к оси ln v равен показателю политропы.
На рис. 12 и 13 представлен пример определения показателя политропы.
|
| i – номер точки | pi, Па | vi, 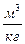
| ln p | ln v |
| p1 | v1 | ln p 1 | ln v 1 | |
| p2 | v2 | ln p 2 | ln v 2 | |
| … | … | … | … | … |
| N | pN | vN | ln p N | ln v N |
|







|
Если все точки не укладываются удовлетворительно на одной прямой, то используется метод линейно-кусочной аппроксимации, по которому показатели политропы определяются для отдельных участков процесса.
 |

 ln p
ln p


 .3. N
.3. N
 . 9
. 9
 . 4
. 4
 . 2
. 2
 . 8
. 8

 .1. 5
.1. 5

 . 6. 7
. 6. 7
|
 ln v
ln v
В этом случае реальный процесс рассчитывается по уравнению pvn = const при последовательно изменяющемся значении показателя политропы n: n1, n2, n3 и т.д. Значения А,Q,U, найденные на отдельных участках процессов затем суммируются.
В тех случаях, когда расчёты выполняются для небольшого участка процесса или для всего процесса известны только две точки, можно использовать метод определения показателя политропы n по двум точкам.
 | |||
 | |||
 1
1



 Р1
Р1
 |

 Р2
Р2
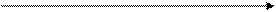 |
V1 V2 V, м3/кг
|
Если реальный процесс задан pv-координатах, то используется уравнение политропы в виде
pvn = p1v1n = p2v2n =const
После логарифмирования и приведения подобных, получим искомое значение n:
ln p1 + n ln v1 = ln p2 + n ln v2
ln p1 – ln p2 = n (ln v2 - ln v1)
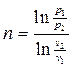 (139)
(139)
В политропном процессе газ считается идеальным. Так как основное уравнение политропы pvn =const по форме совпадает с уравнением адиабаты идеального газа pvk =const (уравнение Пуассона), то без вывода запишем еще два уравнения политропы:
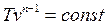 (140)
(140)
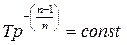 (141)
(141)
Для определения показателя политропы может использоваться любое из трех уравнений политропы.
Так как теплоёмкость является функцией процесса, то получим формулу для теплоёмкости в политропном процессе сn:
Из общей формулы теплоёмкостей однородных систем (74) для политропного процесса имеем:
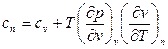 (формула(76))
(формула(76))
Так как в политропном процессе газ считается идеальным, то
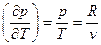 (формула(77))
(формула(77))
Требуется найти 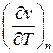 . Для этого воспользуемся уравнением политропы (140):
. Для этого воспользуемся уравнением политропы (140):
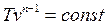 .
.
Логарифмируя и дифференцируя это уравнение, приводя подобные получим:
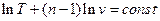
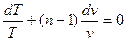
Откуда 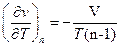
Подставим найденное значение в уравнение (76):
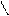
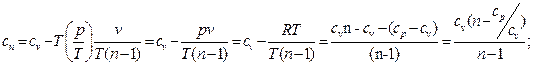
Окончательно
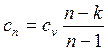 (142)
(142)
В (142) показатель адиабаты k>1, в то время как nÎ(-¥, +¥).
При 1<n<k значение cn получается отрицательным. С физической точки зрения это трудно объяснимо, поэтому, придавая отрицательной величине cn формальный характер, вычисление А, Q, U проводим с этим отрицательным значением.
Изопроцессы, в силу универсальности уравнения 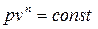 , можно рассмотривать как частные случаи политропного процесса:
, можно рассмотривать как частные случаи политропного процесса:
1) при n = 0 получается уравнение изобарного процесса (p=const);
2) при n = 1 – уравнение изотермического процесса (pv=const);
3) при n = k – уравнение адиабатного процесса pvk=const (или S=const);
4) 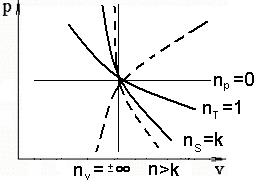 при n = ±¥ - уравнение изохорного процесса (v=const).
при n = ±¥ - уравнение изохорного процесса (v=const).
|
|

|

Дата добавления: 2015-09-01; просмотров: 174 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| III.2. Уравнение адиабаты реального газа в общем виде. | | | IV.2. Работа, теплота и внутренняя энергия в политропном процессе. |