
|
Читайте также: |
Задача№ 207.
Электролиз сульфата меди (II) проводился 12 ч при силе тока 20А. Выход по току составил 90%. Написать уравнение электродных процессов и общей реакции, вычислить массу выделившейся меди.
Решение:
Дано:
t=12часов,
J=20А,
 =90%
=90%
Найти  -?
-?
На аноде возможно:
2S  =S2
=S2 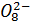 +2
+2 
 =2.01В; 2H2O=O2+4H+ + 4
=2.01В; 2H2O=O2+4H+ + 4 
 =1.23В, так как
=1.23В, так как  , то на аноде выделяется кислород.
, то на аноде выделяется кислород.
На катоде возможно:
 Cu2+ + 2
Cu2+ + 2  =Cu
=Cu  =0.34В; 2H2O+2
=0.34В; 2H2O+2  =H2 + 2OH-
=H2 + 2OH-  = -0.41В
= -0.41В
так как 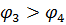 , то на катоде выделится медь
, то на катоде выделится медь
 CuSO4+H2O Cu+O2+2H+ + SO42-
CuSO4+H2O Cu+O2+2H+ + SO42-
 =
=  * 0.9=
* 0.9= 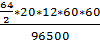 = 257.8г.
= 257.8г.
Ответ:  = 257.8г.
= 257.8г.
Дата добавления: 2015-08-17; просмотров: 127 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Глава № 7. Основы химической термодинамики. | | | Глава 10. Скорость химических реакций. |