
Задача № 360.
Закончить уравнения окислительно-восстановительных реакция, методом полуреакций.
1) H2SO3+ H2SeO4=
2) H2S+KMnO4+H2SO4=
3)SO2+Cl2+H2O =
4)S+HNO3(конц) =
Решение:
1) H2SO3+ H2SeO4=H2SO4+SeO2+H2O
 2) H2S+KMnO4+H2SO4= 5H2S+2KMnO4+3H2SO4 5S+2MnSO4+K2SO4+8H2O
2) H2S+KMnO4+H2SO4= 5H2S+2KMnO4+3H2SO4 5S+2MnSO4+K2SO4+8H2O

 H2S-восстановитель, KMnO4-окислитель
H2S-восстановитель, KMnO4-окислитель
 S-2 - 2
S-2 - 2  S0 5
S0 5
 Mn+7 + 5
Mn+7 + 5  Mn+2 10
Mn+2 10
3) SO2+Cl2+H2O =2HCl+SO3
4) S+HNO3(конц) = H2SO4+6NO2+2H20
Глава 4. p-Элементы пятой группы.
Задача № 394.
Сколько граммов Sb2S3 можно растворить в 200 мл раствора HNO3 с массовой долей 60% ( )? Какой объем (н.у) оксида азота (II) выделится при этом?
)? Какой объем (н.у) оксида азота (II) выделится при этом?
Решение:
m 201.6г V
 Sb2S3+8HNO3 2NO+3S+2Sb(NO3)3+4H2O
Sb2S3+8HNO3 2NO+3S+2Sb(NO3)3+4H2O
340г 8*63 г 2*22.4л
Дано:
Vр-раHNO3 =200мл
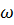 HNO3 =60%
HNO3 =60%
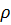 = 1.68г/мл
= 1.68г/мл
Найти: VNO-? mSb2S3-?
1)Масса чистого HNO3: m р-ра = 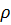 V=200*1.68=336г.
V=200*1.68=336г.
m HNO3 = 336*0.6=201.6г.
2) По уравнению определим массу Sb2S3 и объем NO:
m Sb2S3 =  = 136 г –масса Sb2S3.
= 136 г –масса Sb2S3.
VNO =  = 17,92 л.- объем NO.
= 17,92 л.- объем NO.
Ответ: VNO = 17.92; mSb2S3 = 136 г.
Дата добавления: 2015-08-17; просмотров: 77 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Глава 1. Введение в неорганическую химию. | | | Глава 5. p-Элементы четвертой группы. |