
Читайте также:
|
Задача № 157.
Как формулируется основной закон термохимии и его следствие, как записывается следствие в математическом виде? Написать термохимическое уравнение реакции горения метана, вычислить энтальпию реакции, а также количество теплоты, выделяющейся при сгорании 1м3 метана (объем измерен при н.у).
Решение:
Основной закон термодинамики-закон Гесса (частный случай закона сохранения энергии): Тепловой эффект реакции зависит от начального и конечного состояния вещества, и не зависит от промежуточных стадий процесса.
Следствие закона Гесса: тепловой эффект реакции равен сумме теплот образования продуктов реакции, за вычетом суммы теплот образования исходных веществ.
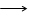 CH4+2O2 2H2O+CO2+802.2 кДж
CH4+2O2 2H2O+CO2+802.2 кДж
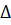 Hх.р. =2
Hх.р. =2 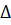 HH2O+
HH2O+ 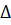 HCO2 -
HCO2 - 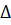 HCH4 = 2*(-241.8)+(-393.5)-(-74.9)
HCH4 = 2*(-241.8)+(-393.5)-(-74.9)
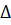 Hх.р. = - 802.2 кДж/моль
Hх.р. = - 802.2 кДж/моль
802.2 кДж выделяется при сгорании 22.4 л. CH4,
Q кДж выделится при сгорании 1000л. CH4
Q=  = 35812.5 кДж.
= 35812.5 кДж.
Глава 8. Химическое равновесие.
Задача №189.
Принцип смещения химического равновесия имеет несколько формулировок. Привести формулировку, которую вы считаете наиболее четкой. Определить направление смещения равновесий реакций:

 2H2(г) + O2(г) 2CO2(г);
2H2(г) + O2(г) 2CO2(г); 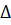 H = -483.6 кДж/моль;
H = -483.6 кДж/моль;

 N2(г) + O2(г) 2NO(г);
N2(г) + O2(г) 2NO(г); 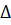 H = 179.0 кДж/моль.
H = 179.0 кДж/моль.
при повышении температуры и понижении давления?
Решение:
Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в таком направлении, что оказанное воздействие будет ослаблено.
2H2(г) + O2(г) = 2H2O(г) 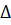 Hх.р. = -483.6 кДж/моль, при повышении температуры равновесие сместится в сторону обратной реакции, так как
Hх.р. = -483.6 кДж/моль, при повышении температуры равновесие сместится в сторону обратной реакции, так как 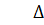 H
H 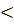 0, то есть реакция экзотермична.
0, то есть реакция экзотермична.
При понижении давления равновесие сместится в сторону обратной реакции, так как здесь в процессе реакции давление понижается (их 3-х моль газа образует 2 моля газа)
CaCO3(к) = CaO(к) + CO2(г)  Hх.р = 19 кДж/моль.
Hх.р = 19 кДж/моль.
Так как 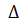 H
H 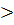 0, то при повышении температуры равновесие сместится в сторону прямой реакции. Так как из кристаллического вещества образуется газообразное соединение, то при понижении давления равновесие сместится в сторону прямой реакции.
0, то при повышении температуры равновесие сместится в сторону прямой реакции. Так как из кристаллического вещества образуется газообразное соединение, то при понижении давления равновесие сместится в сторону прямой реакции.
Дата добавления: 2015-08-17; просмотров: 99 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Глава 3. Окислительно-восстановительные реакции. | | | Глава 9. Электрохимические процессы. |