
|
Читайте также: |
Задача № 563.
Как и почему изменяется сила кислот H2CrO4-H2MoO4-H2WO4? Написать схемы электролитической диссоциации этих кислот, предсказать значения констант их диссоциаций.
Решение:
В ряду H2CrO4-H2MoO4-H2WO4 хром, молибден, вольфрам имеют одинаковую конфигурацию внешнего энергетического уровня, в данном ряду атомный радиус элементов увеличивается, следовательно валентные электроны отдаляются от ряда и их отдача облегчается. Поэтому кислотные свойства, а следовательно и сила кислот в этом ряду уменьшается
H2CrO4  H+ + HCr
H+ + HCr 
HCr 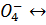 H+ + Cr
H+ + Cr 
H2Mo 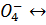 H+ + HMo
H+ + HMo 
HMo 
 H+ + Mo
H+ + Mo 
H2WO4  H+ +HW
H+ +HW 
HWO4  H+ W
H+ W 
8.6 Подгруппа марганца.
Задача № 582.
Рениевую кислоту модно получить окислением рения азотной кислотой. Написать уравнение реакции, вычислить молярную массу эквивалентов окислителя и восстановителя.
Решение:
Re+7HNO3  HReO4+7NO2+3H2O
HReO4+7NO2+3H2O
Re+4H2O  Re
Re  + 8H+ +7
+ 8H+ +7 
N  + 2H+ +1
+ 2H+ +1 
 NO2 + H2O
NO2 + H2O
Re+7  + 14H+ + 4H2O
+ 14H+ + 4H2O  Re
Re  + 8H+ + 7NO2 + 7H2O
+ 8H+ + 7NO2 + 7H2O
Re - восстановитель
Re0 - 7  = Re+7
= Re+7
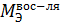 =
= 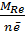 =
=  = 26,6 г/моль
= 26,6 г/моль
HNO3 - окислитель
N+5 + 1  = N+4
= N+4
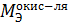 =
= 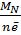 = 14 г/моль.
= 14 г/моль.
Дата добавления: 2015-08-17; просмотров: 191 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Глава 8. Химия d- и f-элементов. | | | Семейство железа. |