
Читайте также:
|
Для получения диаграммы плавления (отвердевания), то есть зависимости температуры расплавляемого (отвердевающего) вещества от времени при неизменных внешних условиях, тигель 1 с исследуемым веществом помещают в печь и, нагревая его, измеряют через определенные промежутки времени температуру 2 вещества в тигле. По результатам измерений строится график. При достаточно медленном нагревании можно считать, что температуры металлической пробы (олова) и тигля одинаковы во всех точках.

Рис.11.1
Методика эксперимента и вывод рабочих формул
Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Если, например, в закрытом сосуде находится вода, то эта система является двухфазной: жидкая фаза – вода; газообразная фаза – смесь воздуха с водяными парами. Если в воду бросить кусочки льда, то эта система станет трехфазной, в которой лед является твердой фазой. Часто понятие «фаза» употребляется в смысле агрегатного состояния, однако следует учитывать, что оно шире, чем понятие «агрегатное состояние». В пределах одного агрегатного состояния вещество может находиться в нескольких фазах, отличающихся по своим свойствам, составу и строению (лед, например, встречается в пяти различных модификациях – фазах). Переход вещества из одной фазы в другую – фазовый переход – всегда связан с качественными изменениями свойств вещества. Примером фазового перехода могут служить изменения агрегатного состояния вещества или переходы, связанные с изменениями в составе, строении и свойствах вещества (например, переход кристаллического вещества из одной модификации в другую).
Различают фазовые переходы двух родов.
Фазовый переход первого рода (например, плавление, испарение, кристаллизация и т. д.) сопровождается поглощением или выделением теплоты, называемой теплотой фазового перехода. Данные переходы характеризуются постоянством температуры, изменениями энтропии и объема. Объяснение этому можно дать следующим образом. Например, при плавлении телу нужно сообщить некоторое количество теплоты, чтобы вызвать разрушение кристаллической решетки. Подводимая при плавлении теплота идет не на нагрев тела, а на разрыв межатомных связей, поэтому плавление протекает при постоянной температуре. В подобных переходах – из более упорядоченного кристаллического состояния в менее упорядоченное жидкое состояние – степень беспорядка увеличивается, то есть, согласно второму началу термодинамики, этот процесс связан с возрастанием энтропии системы. Если переход происходит в обратном направлении (кристаллизация), то система теплоту выделяет.
Фазовые переходы, не связанные с поглощением или выделением теплоты и изменением объема, называются фазовыми переходами второго рода. Эти переходы характеризуются постоянством объема и энтропии, но скачкообразным изменением теплоемкости. Общая трактовка фазовых переходов второго рода предложена советским ученым Л. Д. Ландау (1908–1968). Согласно этой трактовке, фазовые переходы второго рода связаны с изменением симметрии: выше точки перехода система, как правило, обладает более высокой симметрией, чем ниже точки перехода. Примерами фазовых переходов второго рода являются: переход ферромагнитных веществ (железа, никеля) при определенных давлении и температуре в парамагнитное состояние; переход металлов и некоторых сплавов при температуре, близкой к  , в сверхпроводящее состояние, характеризуемое скачкообразным уменьшением электрического сопротивления до нуля; превращение обыкновенного жидкого гелия при
, в сверхпроводящее состояние, характеризуемое скачкообразным уменьшением электрического сопротивления до нуля; превращение обыкновенного жидкого гелия при  в другую жидкую модификацию, обладающую свойствами сверхтекучести.
в другую жидкую модификацию, обладающую свойствами сверхтекучести.
Плавление – переход вещества из кристаллического (твердого) состояния в жидкое – происходит с поглощением тепла (фазовый переход первого рода). Наличие температуры плавления  – важный признак кристаллического твердого тела. Переход начинается при
– важный признак кристаллического твердого тела. Переход начинается при  и протекает при
и протекает при 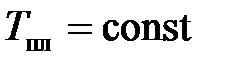 не смотря на приток теплоты. По этому признаку отличают кристаллические тела от аморфных твердых тел, которые не имеют фиксированной
не смотря на приток теплоты. По этому признаку отличают кристаллические тела от аморфных твердых тел, которые не имеют фиксированной 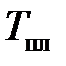 .
.
Плавление сопровождается изменением физических свойств вещества: увеличением энтропии, ростом теплоемкости и электрического сопротивления. Практически до нуля подает сопротивление сдвигу (в жидкости не распространяются упругие поперечные волны), уменьшается скорость распространения звука (продольных волн) и др.

Рис 11.2
Согласно молекулярно-кинетической представлениям, плавление осуществляется следующим способом:
1. При подводе к кристаллическому телу тепла увеличивается энергия колебаний (амплитуды) его атомов, что приводит к повешению температуры и способствует образованию в кристалле различных дефектов (не заполнению кристаллической решетки, нарушению периодичности внедрившимися между ее узлами атомами. Постепенный рост числа дефектов и их объедение характеризует стадию предплавления.
2. С достижением  (рис 11.2) в кристалле создается критическая концентрация дефектов, начинается плавление – кристаллическая решетка распадается на легкоподвижные субмикроскопические области. Подводимое тепло идет на разрушение дальнего порядка в кристаллах (упорядоченностей повторяющихся на неограниченно большом расстоянии).
(рис 11.2) в кристалле создается критическая концентрация дефектов, начинается плавление – кристаллическая решетка распадается на легкоподвижные субмикроскопические области. Подводимое тепло идет на разрушение дальнего порядка в кристаллах (упорядоченностей повторяющихся на неограниченно большом расстоянии).
3. В самих же субмикронных областях ближний порядок в расположении атомов при плавлении существенно не меняется. При этом координационное число (число ближайших к данному атому соседних атомов в кристаллической решётке) расплава при  в большинстве случаев остается тем же, что и у кристалла.
в большинстве случаев остается тем же, что и у кристалла.
В данной работе в качестве примера обратимого процесса изучается плавление и кристаллизация олова. На рис. 11.3 изображена типичная зависимость потенциальной энергии взаимодействия двух атомов в веществе в зависимости от их взаимного расстояния (парный потенциал взаимодействия). Величина 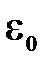 называется энергией связи,
называется энергией связи,  – равновесное состояние. Если температура вещества не очень велика, так что средняя кинетическая энергия теплового движения атомов
– равновесное состояние. Если температура вещества не очень велика, так что средняя кинетическая энергия теплового движения атомов  , то атомы совершают колебания между точками
, то атомы совершают колебания между точками  и
и  с относительно небольшой амплитудой.
с относительно небольшой амплитудой.

Рис 11.3
При этом вещество находится в кристаллическом состоянии ( – средняя энергия атомов в этом состоянии). Если путем нагревания повысить эту среднюю энергию до
– средняя энергия атомов в этом состоянии). Если путем нагревания повысить эту среднюю энергию до 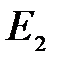 , что соответствует средней кинетической энергии атомов
, что соответствует средней кинетической энергии атомов
 , (11.1)
, (11.1)
увеличивается средняя амплитуда колебаний атомов (между  и
и  ).
).
Кроме того, поскольку значительная часть атомов имеет энергию выше средней, происходит интенсивная миграция атомов (разрыв связей с последующим воссоединением их воссоединением их в другой комбинации), т.е. вещество становиться текучим (жидкость).
Наконец, газообразному состоянию вещества соответствует случай  .
.
Если тепловая мощность  , подводимая к образцу, может считаться постоянной, то ось времени на рис.11.2 является одновременно и осью теплоты, поглощенной образцом и тиглем. Тепловая мощность
, подводимая к образцу, может считаться постоянной, то ось времени на рис.11.2 является одновременно и осью теплоты, поглощенной образцом и тиглем. Тепловая мощность 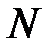 , конечно, не равна мощности нагревателя, так как часть теплоты рассеивается в окружающую среду.
, конечно, не равна мощности нагревателя, так как часть теплоты рассеивается в окружающую среду.
Участки возрастания температуры на рис.11.2 изображают нагревание твердого образца и тигля (слева) и нагревание расплава и тигля (справа). Тепловая мощность на любом участке равна изменению внутренней энергии системы в единичное время
 , (11.2)
, (11.2)
где  – масса образца олова;
– масса образца олова;  – удельная теплоемкость олова;
– удельная теплоемкость олова; 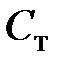 – теплоемкость тигля вблизи температуры плавления.
– теплоемкость тигля вблизи температуры плавления.
Горизонтальный участок на рис.11.2 изображает процесс плавления металла. Здесь выполняется равенство
 , (11.3)
, (11.3)
где 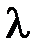 – теплота плавления олова;
– теплота плавления олова; 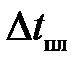 – время плавления олова.
– время плавления олова.
Из (11.2) и (11.3) можно получить формулу, позволяющую по диаграмме плавления (отвердевания) олова рассчитать его теплоту плавления 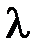 .
.
 . (11.4)
. (11.4)
Вычислим количество тепла, необходимое для плавления куска олова массой 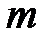 . Поскольку каждый атом в кристалле олова окружен 12-ю ближайшими соседями с парным потенциалом взаимодействия, изображенным на рис.11.3, то на каждый атом в среднем придется затратить количество тепла равное
. Поскольку каждый атом в кристалле олова окружен 12-ю ближайшими соседями с парным потенциалом взаимодействия, изображенным на рис.11.3, то на каждый атом в среднем придется затратить количество тепла равное  . В действительности для оценки теплоты плавления этот результат необходимо поделить пополам, так как, когда вещество находится в жидком агрегатном состоянии, в любой момент времени разорвана примерно половина межатомных связей. Если масса одного атома
. В действительности для оценки теплоты плавления этот результат необходимо поделить пополам, так как, когда вещество находится в жидком агрегатном состоянии, в любой момент времени разорвана примерно половина межатомных связей. Если масса одного атома  равна
равна  ,то полное количество тепла для всего кристаллаолова
,то полное количество тепла для всего кристаллаолова
 , (11.5)
, (11.5)
где  и
и  – число Авогадро и молярная масса олова соответственно.
– число Авогадро и молярная масса олова соответственно.
Из (11.5) можно найти удельную теплоту плавления  :
:
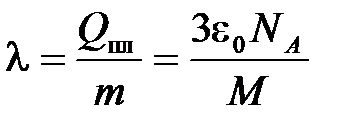 . (11.6)
. (11.6)
Таким образом, из (11.6) можно установить связь между 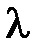 и
и 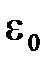 :
:
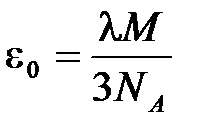 . (11.7)
. (11.7)
При нагревании и последующем плавлении металла происходит переход из более упорядоченного (кристаллического) состояния в менее упорядоченное – жидкое. Количественной мерой степени молекулярного беспорядка в системе в любом агрегатном состоянии является энтропия.
Приведенным количеством теплоты называется сообщенное телу тепло, отнесенное к температуре, при которой это тепло сообщалось:
 .
.
Последняя формула справедлива лишь для изотермического процесса. Приведенное количество теплоты, полученное системой на бесконечно малом участке произвольного процесса, равно
 .
.
Для обратимого процесса
 .
.
Таким образом, величина  является полным дифференциалом некоторой функции
является полным дифференциалом некоторой функции  :
:
 .
.
Круговым процессом (циклом) называют совокупность термодинамических процессов, в результате которых система возвращается в исходное состояние. Термодинамический процесс называется обратимым, если при совершении его термодинамической системой сначала в прямом, а затем в обратном (через ту же последовательность промежуточных состояний) направлении как сама система, так и все внешние тела, с которыми система взаимодействовала, возвращаются в исходное состояние. При обратимом процессе термодинамическая система в каждый момент времени должна находиться в термодинамическом равновесии.
Термодинамическое определение энтропии. Функция состояния термодинамической системы, полным дифференциалом которой является выражение  , называется энтропией и обозначается
, называется энтропией и обозначается  . Энтропия определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние.
. Энтропия определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние.
Если система одного из состояния с параметрами  перешла другое состояние с параметрами
перешла другое состояние с параметрами 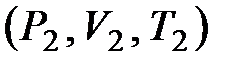 , то изменение энтропии будет определяться следующим образом:
, то изменение энтропии будет определяться следующим образом:
 . (11.8)
. (11.8)
Это равенство позволяет рассматривать энтропию как меру необратимого рассеяния энергии.
Статистическое определение энтропии. Рассмотрим систему, состоящую из очень большого количества частиц. Состояние макроскопического тела, т.е. тела, образованного огромным количеством молекул, может быть задано с помощью макроскопических характеристик:  . Охарактеризованное таким образом состояние называется макросостоянием.
. Охарактеризованное таким образом состояние называется макросостоянием.
В свою очередь состояние системы можно охарактеризовать мгновенным распределением всех образующих тело молекул, т.е. определить их координаты и импульсы. Такое состояние называется микросостоянием. Термодинамической вероятностью (статистическим весом  ) называется число различных микросостояний, соответствующих данному макросостоянию.
) называется число различных микросостояний, соответствующих данному макросостоянию.
Согласно Больцману, энтропия системы и термодинамическая вероятность связаны между собой следующим образом:
 , (11.9)
, (11.9)
где  – постоянная Больцмана.
– постоянная Больцмана.
Свойства энтропии:
1) энтропия системы, находящейся в равновесном состоянии, максимальна;
2) энтропия изолированной системы при обратимом процессе (цикле) не изменяется:
 ;
;
3) при любом необратимом процессе энтропия изолированной системы тел в целом возрастает
 ,
,
а так как реальные процессы всегда необратимы, то можно утверждать, что все процессы в изолированной системе ведут к увеличению ее энтропии;
4) энтропия обладает свойством аддитивности: энтропия термодинамической системы равна сумме энтропий тел, входящих в систему.
Первое начало термодинамики, выражая закон сохранения и превращения энергии, не позволяет установить направление протекания термодинамических процессов. Некоторых процессов, удовлетворяющих ему, в природе не существует. Примером такого процесса является вечный двигатель второго рода – периодически действующая машина, которая превращает всю теплоту, полученную от термостата, в работу.
Для определения направления протекания термодинамических процессов было сформулировано второе начало термодинамики: энтропия изолированной системы не может убывать при любых происходящих в ней процессах:
 ,
,
где знак равенства относится к обратимым процессам, а знак «больше» – к необратимым процессам.
Упрощенная зависимость температуры олова от времени разогрева качественно изображена на рис 11.4. Здесь  и
и  – комнатная температура и температура плавления, а
– комнатная температура и температура плавления, а  ,
,  – время разогрева и плавления соответственно.
– время разогрева и плавления соответственно.
Изменение энтропии олова на участке 1 - 3 можно вычислить как
 .
.
Учитывая, что на участке 1 - 2 разогрева
 ,
,
где  – удельная теплоемкость олова, а на участке 2 - 3
– удельная теплоемкость олова, а на участке 2 - 3 
 ,
,
из термодинамического определения энтропии получаем
 (11.10)
(11.10)
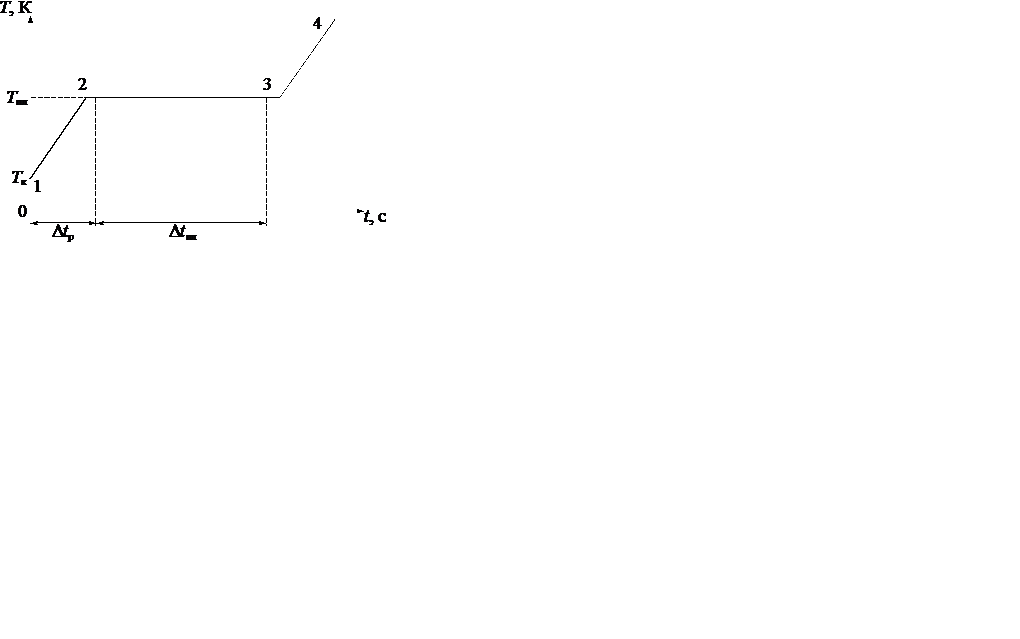
Рис 11.4
Здесь полагаем, что для процесса разогрева и плавления выполнены условия обратимости. Это означает, что при выключении нагревателя в 4 (рис.11.4), кривая охлаждения 4 - 1 совпадет с кривой нагрева 1 - 4. Время кристаллизации 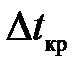 на участке 3-2 должно совпадать с временем плавления
на участке 3-2 должно совпадать с временем плавления  . Реально протекающий процесс не является квазиравновесным и обратимым, то есть у кривой охлаждения 4 - 1 нет строгого количественного совпадения с 1 - 4.
. Реально протекающий процесс не является квазиравновесным и обратимым, то есть у кривой охлаждения 4 - 1 нет строгого количественного совпадения с 1 - 4.
Дата добавления: 2015-08-17; просмотров: 75 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Лабораторная работа 10 | | | Задание к работе |