
|
Читайте также: |
Решение качественных задач методами спектрофотометрии часто оказывается существенно более сложным и трудоёмким, чем решение задач количественных. Дело в том, что для выявления присутствия (или отсутствия) какого-либо соединения в исследуемом образце обязательно требуется регистрация спектров поглощения этого образца в том диапазоне длин волн, где выявляемое соединение обладает способностью к поглощению света.
Определение 12:
Спектром поглощения называется зависимость оптической плотность( D ), молярного коэффициента поглощения ( e ) или поперечного сечения поглощения ( r ) исследуемого соединения от длины волны тестирующего излучения (энергии его квантов, их частоты или волновых чисел).
Иногда вместо спектра поглощения используется спектр пропускания изучаемого образца.
Определение 13:
Спектром пропускания называется зависимость светопропускания ( Т ) исследуемого соединения от длины волны тестирующего излучения (энергии его квантов, их частоты или волновых чисел).
На практике, однако, спектры пропускания чаще всего применяют для характеристики светофильтров. Для решения же качественной спектрофотометрической задачи такие спектры менее удобны.
Решение качественной задачи на основании анализа спектров поглощения исследуемого образца основывается на том, что у каждого типа молекул имеется специфическая структура электронных орбиталей (см. выше) и, соответственно, специфический спектр поглощения.
Как правило, качественная задача решается путем сопоставления спектра образца и стандартного спектра поглощения выявляемого соединения. Стандартный спектр поглощения выявляемого соединения в чистом виде может быть найден в литературе (имеются, например, специальные альбомы спектров поглощения наиболее распространенных веществ) или измерен самостоятельно, на том же спектрофотометре, на котором будет измеряться спектр поглощения изучаемого объекта. Последний вариант предпочтительнее.
Имеется ряд показателей поглощения, которые могут использоваться при решении качественной задачи эмпирическим путем. Например, если выявляемое соединение обладает поглощением в видимой области спектра, содержащие его образцы (при оптической плотности ³ 0,06) будут заметно окрашены в цвета, дополнительные к области поглощения. Растворы гемоглобина, в частности, имеют красную окраску потому, что гем (хромофорная часть молекулы гемоглобина) поглощает излучение в синей и зеленой частях видимого спектрального диапазона, но не поглощает красное излучение (длиннее 620 нм). Известно также, что положение наиболее длинноволновых максимумов на спектре поглощения зависит от числа сопряженных (разделенных не более, чем одной одинарной s -связью) двойных p -связей в молекуле-хромафоре: чем больше количество таких связей, тем в более длинноволновой области (при прочих равных условиях) оказывается длинноволновый максимум. Связано это с тем, что в системе сопряженных двойных p -связей p -электроны делокализованы по всей этой системе, и их взаимодействие с каждым из входящих в эту систему ядер ослаблено. Квантово-механические расчёты показывают, что положение длинноволнового максимума (lmax) в спектре поглощения при разном количестве сопряженных двойных p -связей (N) может быть примерно определено по формуле:
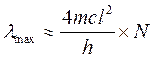
где m – масса электрона, с – скорость света, h – постоянная Планка, l – длина одного звена системы.
Если химическая структура выявляемого вещества точно известна, можно примерно рассчитать положение lmax длинноволновой полосы его поглощения по этой формуле. При отсутствии подобной полосы в спектре поглощения объекта данное соединение в нем, скорее всего, отсутствует.
Сопоставление спектров образца и стандартного спектра поглощения выявляемого соединения проводится на основании сравнения так называемых качественных признаков полос поглощения на них. Этих признаков 3:
(1) Точное спектральное положение максимумов поглощения (lmax).
(2) Полуширины полос поглощения (Dl1/2).
(3) Соотношение амплитуд максимумов поглощения (этот признак применяется, если на стандартном спектре выявляемого вещества имеется более, чем 1 максимум поглощения).
Определение 14:
Полушириной полосы поглощения (Dl1/2) называется ее спектральная ширина на половине амплитуды (рис. 4).


|
|
|
|
|


|
|
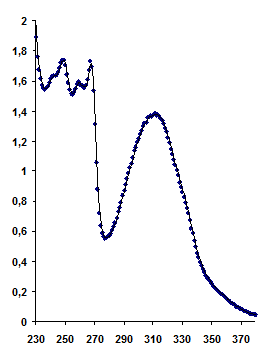
Рисунок 4. Схема расчета полуширины полосы поглощения (Dl1/2). Для расчета этого показателя определяется спектральная ширина (l2-l1) полосы поглощения на половине её амплитуды (1/2Dmax). В качестве примера приведён спектр поглощения этанольного раствора 5-метоксипсоралена. По осям: l - длина волны тестирующего излучения, нм; D – оптическая плотность.
В чистых физических объектах (например, в разреженных газах), особенно при низких температурах, близких к 0оК, молекулы практически не взаимодействуют друг с другом, из-за чего спектры поглощения имеют линейчатый вид. Однако в растворах вследствие взаимодействия молекул хромофора с растворителем у каждой молекулы происходит некоторое изменение структуры электронных орбиталей, причем этот сдвиг зависит от ориентации молекул растворителя, степени их полярности и расстояния до них в момент поглощения кванта излучения хромофором. Энергия такого сдвига, таким образом, индивидуальна для каждой молекулы-хромофора в растворе. Она не квантована и может принимать любые значения в определенном интервале. В результате в спектре поглощения в растворе наблюдается суперпозиция огромного числа смещенных линий поглощения. Это приводит к тому, что вместо линий поглощения в таких спектрах наблюдаются полосы с достаточно большими значениями Dl1/2. При температуре в 20-25оС в водных растворах Dl1/2 полос поглощения на спектрах составляет до нескольких десятков нанометров.
Отдельные полосы поглощения в таких случаях достаточно хорошо описываются кривыми Гаусса (уравнение 24) или Лоренца (уравнение 25):
|
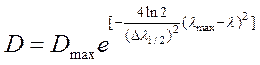
|
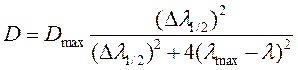
где D – величина оптической плотности образца при текущей длине волны измерения; Dmax – максимальное значение оптической плотности в полосе (её амплитуда); Dl1/2 – полуширина полосы; lmax – спектральное положение максимума полосы.
Для того, чтобы успешно решить качественную спектрофотометрическую задачу, важно, чтобы вышеуказанные качественные признаки на измеренном спектре поглощения можно было точно рассчитать. Для этого нужно, чтобы полосы поглощения на анализируемом спектре были хорошо различимы и разделены достаточно глубокими минимумами. Характеристика спектра, которая отражает, насколько различимы отдельные полосы поглощения на нем, называется разрешением.
Для повышения разрешения полос на спектрах поглощения их измерение следует проводить при небольшой спектральной ширине тестирующего пучка излучения (она должна быть в 10 раз меньше, чем полуширины полос поглощения на измеряемом спектре). Кроме того, поскольку часто спектр поглощения регистрируется по отдельным точкам (даже в автоматическом режиме), частота расположения точек измерения по спектру (интервал по длинам волн между соседними точками) должна быть не менее, чем в 10 раз, меньше полуширины полос поглощения. Например, если предполагаемая полуширина анализируемой полосы поглощения – 30 нм, измерения оптической плотности следует проводить не реже, чем каждые 3 нм, а при полуширине полосы 10 нм – не реже, чем каждый 1 нм.
В физике для описания разрешения полос применяют так называемый критерий Релея, который формулируется следующим образом:
Две соседние полосы поглощения одинаковой амплитуды и полуширины считаются полностью разрешенными, если глубина провала между этими полосами составляет не менее половины их амплитуды.
К сожалению, ряд причин, которые приведены ниже, приводит к тому, что критерий Релея для оценки разрешения спектров поглощения биологических объектов неприменим. Иногда отдельным максимумом поглощения на таких спектрах приходится считать полосу, отделенную от соседней просто хоть сколько-нибудь заметным провалом.
Причины же плохого разрешения спектров поглощения биологических образцов следующие:
(1) Как правило, биологические образцы многокомпонентны и содержат несколько типов хромофорных молекул. Максимумы поглощения хромофоров разных типов могут быть расположены близко друг к другу, из-за чего полосы поглощения перекрываются.
(2) Все биологические образцы содержат воду. Вода, являясь полярным растворителем, склонна к сильному взаимодействию с растворенными в ней соединениями, формируя вокруг них гидратационные оболочки. Вместе с тем, такое взаимодействие приводит к изменению структуры электронных уровней и подуровней в молекулах растворенных веществ и, как следствие, к увеличению полуширин полос их поглощения. Это, естественно, также ухудшает разрешение спектров поглощения.
(3) Биологические объекты, как правило, структурированы. Иными словами, молекулы хромофоров в них не пребывают в свободном состоянии, а входят в состав сложных надмолекулярных комплексов (например, биологических мембран). Эти надмолекулярные комплексы стабильны благодаря взаимодействию входящих в них молекул друг с другом. Как и взаимодействие с растворителем, межмолекулярные взаимодействия приводят к увеличению полуширины полос поглощения хромофоров, что ухудшает разрешение спектров.
(4) Измерение спектров поглощения биологических объектов обычно проводится в физиологическом диапазоне температур (от 20 до 40о С). Однако по шкале Кельвина (абсолютной температурной шкале, используемой при описании квантово-механических процессов, см. выше), это достаточно высокие температуры (37оС = 310оК), при которых полуширины полос поглощения оказываются достаточно велики из-за заселения электронами отдаленных тепловых колебательных подуровней.
Указанные причины приводят к тому, что решение качественной задачи в биологических образцах оказывается сильно затруднено. Для того, чтобы увеличить разрешение спектров поглощения в таких случаях прибегают к специальным приёмам, которые будут описаны ниже.
Качественная задача считается решенной положительно (т.е. делается заключение о присутствии выявляемого вещества в образце), если все 3 качественных признака на спектре поглощения исследуемого образца и на стандартном спектре поглощения выявляемого соединения совпадают или очень близки. Например, на стандартном спектре поглощения раствора чистого вещества А имеются 2 максимума поглощения при l1 и l2 с полуширинами в 25 и 35 нм и с соотношением амплитуд 3,2:1. На измеренном спектре поглощения тестируемого образца также имеются 2 максимума (могут быть и другие полосы, но мы обращаем внимание на эти) при l1 и l2 с полуширинами в 23 и 36 нм и с соотношением амплитуд 3,17:1. В такой ситуации можно с высокой вероятностью утверждать, что вещество А в изученном образце присутствует.
Можно решить качественную задачу и при совпадении на спектре поглощения образца и стандартном спектре поглощения выявляемого соединения 1-2 качественных признаков, но в таких случаях вероятность неправильного заключения сильно возрастает.
Дата добавления: 2015-07-25; просмотров: 294 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Условия выполнения закона Бугера-Ламберта-Бера. | | | Количественный спектрофотометрический анализ. |