
Читайте также:
|
Внутренняя энергия атомов и молекул складывается из энергии электронов, находящихся в электростатическом взаимодействии с ядрами, энергии колебания самих ядер относительно друг друга и энергии вращения молекулы (атома) как целого.
Поскольку электрон может рассматриваться не только как частица, но и как волна, для расчета его энергии в молекулах может применяться уравнение Шредингера, количественно описывающее свойства стоячих волн в модели так называемого потенциального ящика. Заметим, что данное уравнение постулировано, а не выведено. Однако в настоящее время многочисленные экспериментальные данные позволяют считать его верным.
В упрощенном виде для стационарного случая уравнение Шредингера выглядит следующим образом:
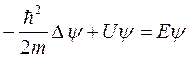 …(7)
…(7)
После замены 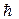 на h (h = 2p
на h (h = 2p 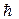 ) получим:
) получим:
 (8)
(8)
В уравнении (8) y - так называемая волновая функция (пси-функция), описывающая электромагнитные возмущения в системе; D - оператор Лапласа, представляющий собой сумму вторых частных производных от стоящей за ним величины по всем 3 пространственным направлениям. Иными словами:
 (9)
(9)
Е – полная, а U – потенциальная энергии частицы, m – её масса (электрон, в отличие от фотона, обладает массой покоя).
Уравнение Шредингера является дифференциальным уравнением второго порядка, решение которых не всегда возможно и является сложной математической задачей. Тем не менее, известны решения этого уравнения для одномерного случая (электронные волны в потенциальном ящике одномерны) и для атома водорода. Мы приведем здесь только одно решение – для модели одномерного потенциального ящика:
 (10)
(10)
Квадрат модуля волновой функции |y|2 соответствует вероятности пребывания электрона в данной точке (или вблизи нее), величина y0 – амплитуда изменения волновой функции, l – длина (размер) потенциального ящика, а n принято называть главным квантовым числом. Оно принимает только целочисленные значения – 1, 2, 3 и т.д. Из полученного решения (уравнение (10)) вытекает, что из-за своих волновых свойств электроны обязаны пребывать на определенных орбиталях (уровнях), соответствующих местам формирования стоячих волн в молекуле (рассматриваемой как «потенциальный ящик») вследствие интерференции. Каждой такой орбитали (уровню) соответствует определенное значение энергии электрона, пропорциональное n2:
 (11)
(11)
где Ее – энергия электрона, а m – его масса.
Что касается расчета распределения электронных плотностей в реальных атомах, то из-за своей сложности, как уже указывалось выше, он был произведен только для атома водорода. Для более крупных атомов или многоатомных молекул расчет затруднен в связи с тем, что в трехмерном пространстве стоячие электронные волны будут формироваться в трех измерениях, и для их характеристики требуются, как минимум, три квантовых числа. Тем читателям, которые хотят более подробно ознакомиться с квантово-механическими принципами расчетов электронных орбиталей, можно рекомендовать обратиться к специальным учебникам по квантовой химии и физике.
На основании приведенных выше квантово-механических уравнений можно сделать следующие заключения:
В каждом типе молекул имеется набор занятых и свободных электронных орбиталей (электронных уровней). Величина энергий, необходимых для электронных переходов между этими орбиталями, определяется структурой молекулы, вследствие чего для каждого типа молекул набор этих энергий уникален и может служить своеобразным «отпечатком пальца» этого соединения. Следует, впрочем, заметить, что обычно молекулы находятся в окружении других молекул (например, молекул растворителя) и взаимодействуют с ними тем или иным образом. Такое взаимодействие может повлиять на энергии занятых и свободных электронных орбиталей. Иногда это влияние бывает достаточно сильно.
Как следует из табл. 1, энергии квантов излучения, приходящегося на оптический спектральный диапазон, позволяют им взаимодействовать преимущественно с электронными оболочками атомов и молекул.
Электроны в молекулах принято разделять на три группы. Это:
Указанные типы электронов в молекулах располагаются соответственно на n -; s- и p - молекулярных электронных орбиталях. Заметим, что электроны на s- и p - молекулярных орбиталях, формирующих ковалентные связи между составляющими молекулами атомами, обобщены и не являются «собственностью» какого-либо из атомных ядер данной молекулы.
Кванты излучения могут взаимодействовать с электронами любого типа, однако для возбуждения n- и s -электронов требуются значительные энергии, поэтому на них оказывают влияние только кванты с малой длиной волны (т.е. большой энергией), входящие в так называемый вакуумный ультрафиолетовый спектральный поддиапазон.
Следствием взаимодействия кванта с электроном является увеличение энергии последнего на величину, соответствующую энергии поглощенного кванта излучения. Из приводившихся выше квантово-механических моделей следует, что изменение энергии электрона с неизбежностью приводит к тому, что он оказывается вынужден изменить свою орбиталь в молекуле, заняв ту из них, которая соответствует новому значению его энергии (см уравнение (11)). Вместе с тем, для такого перехода электрону требуется совершенно определенная порция энергии, соответствующая разнице в этом показателе между «старой» и «новой» орбиталями (орбитали квантованы, каждая из них соответствует определенным значениям квантовых чисел, которые могут быть только целыми). Поэтому электроны молекул взаимодействуют не с любыми квантами, а только с теми из них, энергия которых удовлетворяет вышеуказанному требованию. Кванты же, не удовлетворяющие ему, взаимодействовать с электронами данной молекулы не будут.
На практике это означает, что взаимодействие квантов излучения оптического спектрального диапазона с молекулами будет различным у фотонов с разной длиной волны (частотой, волновым числом). Излучение с «подходящими» по энергии (или, что то же самое, по l, v или n) квантами будет при прохождении через содержащий конкретные молекулы объект ослабляться сильно, а с «неподходящими» - слабо (может даже проходить через объект совсем без ослабления). Напомним, что у каждого типа молекул – свой набор электронных орбиталей, различающихся по энергиям, определяющийся структурой молекул данного типа. Поэтому каждый определенный тип молекул будет ослаблять излучения с определенными l, v и n. Это обстоятельство позволяет решать с помощью оценки ослабления образцом излучения с разными l (v или n) качественные задачи, т.е. выявлять присутствие в объекте конкретных химических соединений.
Рассмотрим теперь, что происходит с электронами в молекулах после поглощения квантов электромагнитного излучения оптического спектрального диапазона.
Дата добавления: 2015-07-25; просмотров: 90 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Доза излучения | | | Электронные переходы в атомах и молекулах при поглощении квантов оптического излучения. |