
Читайте также:
|
1. Рассчитайте величину удельного вращения 2% раствора кислоты аскорбиновой в воде, если угол вращения этого раствора, измеренный в кювете длиной 10 см. равен +4,4°.
Решение:
Расчет удельного вращения проводят по формуле:
 ± = = +2200
± = = +2200
 Ответ: +2200.
Ответ: +2200.
2. Рассчитайте концентрацию раствора глюкозы, если показатель преломления анализируемого раствора равен 1,338, показатель преломления воды 1,333. Фактор показателя преломления безводной глюкозы равен 0,00142.
Решение:
Концентрацию раствора глюкозы в % рассчитывают по формуле:
 C = = 35,2%
C = = 35,2%
Ответ: 35,2%.
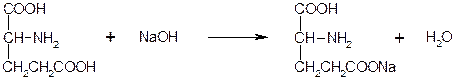
3. Приведите уравнение реакции количественного определения аскорбиновой кислоты (М.м.=176,1) методом йодатометрии. Рассчитайте содержание аскорбиновой кислоты, если на титрование навески 0,1012 г было израсходовано 11,2 мл 0,0167 М раствора калия йодата (К=1,0).
Решение:
KIO3 + 5KI + 6HCl ¾® 3I2 + 6KCl + 3H2O

ТА/В = 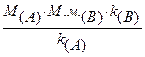 =
=  = 8,82 мг/мл = 0,008823 г/мл
= 8,82 мг/мл = 0,008823 г/мл
Х, % =  =
= 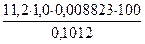 = 97,6%
= 97,6%
Ответ: 8,82 мг/мл; 97,6%
4. Приведите уравнения реакций количественного определения натрия бензоата (М.м.=144,1) методом ацидиметрии в водно-эфирной среде. Рассчитайте титр по определяемому веществу, массу навески натрия бензоата, чтобы на титрование пошло 20,0 мл 0,5 М раствора хлористоводородной кислоты (К=1,02).
Решение:
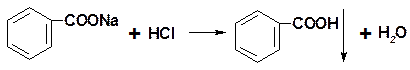 |
ТА/В = 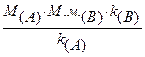 =
= 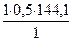 = 72 мг/мл = 0,072 г/мл
= 72 мг/мл = 0,072 г/мл
Расчет массы навески:
a =V . K . T = 20 . 1,02 . 0,072 = 1,44(г)
Ответ: 0,072 г/мл; 1,44 г.
5. Приведите уравнения реакций количественного определения цинка сульфата (М.м.=287,54) методом комплексонометрии. Рассчитайте объем 0,05 М раствора трилона Б (К=0,98), который пойдет на титрование навески цинка сульфата массой 0,2436 г.
 Решение:
Решение:
1.

2.

3.
ТА/В = 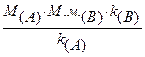 =
= 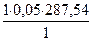 = 14,38 мг/мл = 0,0144 г/мл
= 14,38 мг/мл = 0,0144 г/мл
Расчет объема титранта: V =  =
= 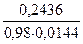 ≈ 17,3 мл
≈ 17,3 мл
Ответ: 0,0144 г/мл; 17,3 мл
6. Приведите уравнения реакций количественного определения глютаминовой кислоты методом алкалиметрии. Рассчитайте содержание глютаминовой кислоты (М.м.=147,1) в одной таблетке, если на титрование 0,261 г порошка растертых таблеток пошло 16,7 мл 0,1 М раствора натрия гидроксида (К=1,01). Средняя масса таблетки (Р) равна 0,264 г.
ТА/В = 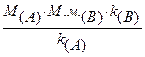 =
=  = 14,71 мг/мл = 0,01471 г/мл
= 14,71 мг/мл = 0,01471 г/мл
Х, г = 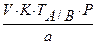 =
=  = 0,248 г
= 0,248 г
Ответ: 0,01471 г/мл; 0,248 г.
7. Приведите уравнения реакций количественного определения кислоты салициловой (М.м. 138,12) методом обратной броматометрии. Укажите индикатор, переход его окраски в точке конца титрования. Рассчитайте титр титранта по определяемому веществу, одержание кислоты салициловой, если к навеске массой 0,0576 г добавлено 50,0 мл 0,0167 М раствора калия бромата (К=0,98). На титрование избытка указанного титранта в основном опыте пошло 23,75 мл 0,1 М раствора натрия тиосульфата (К = 1,02), в контрольном опыте - 48,0 мл.
Решение:
Дано: M.м. 138,12! KBrO3 + 5KBr + 3H2SO4→ 3Br2 + 3K2SO4 + 3 H2O
 Vк.о.=48 мл; а=0,0576г!
Vк.о.=48 мл; а=0,0576г!
V=23,75 мл; К =1,02;!
МКВrО3 = 0,0167!
--------------------------------------!
Найти: Т А/В, С%! Br2 + 2KI → I2 + 2 K
I2 + 2Na2S2O3 →2NaI + Na2S4O6
Титр титранта Т А/В =  =
=  =
=
= 0,00230(г/мл)= 2,30(мг/мл);
Содержание:
C% =  = 98,85%
= 98,85%
Ответ: 2,3мг/мл; 98,85%.
8. Приведите уравнения реакций количественного определения резорцина (M.м. 110,11) методом обратной броматометрии. Рассчитайте титр титранта по определяемому веществу, объем 0,1 М раствора натрия тиосульфата (К=1,0), который пойдет на титрование избытка 0,0167 М раствора калия бромата (К=1,0), добавленного в количестве 40,0 мл к аликвоте объемом 20,0 мл. Аликвота взята из раствора, полученного после растворения и доведения водой до метки в мерной колбе вместимостью 100,0 мл навески резорцина массой 0,29845 г.
Решение:
KBrO3 + 5KBr + 3H2SO4→ 3Br2 + 3K2SO4 + 3 H2O

Br2 + 2KI → I2 + 2 KBr
I2 + 2Na2S2O3 →2NaI + Na2S4O6
Титр титранта Т А/В =  =
= 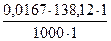 =
=
= 0,00230(г/мл)= 2,30(мг/мл).
9. Рассчитайте содержание фурадонина (g, %), если точную навеску анализируемого образца массой 0,0986 г (а) внесли в мерную колбу вместимостью 100,0 мл (W1), добавили 2,5 мл 0,1 моль/л раствора натрия гидроксида. После растворения довели водой до метки. 0,6 мл (V) полученного раствора довели водой до метки в мерной колбе вместимостью 100,0 мл (W2).
Оптическая плотность испытуемого раствора, измеренная на спектрофотометре при длине волны 360 нм в кювете с толщиной слоя (l) 1,0 см относительно воды, составила 0,274 (Ах).
Удельный показатель поглощения ( ) раствора фурадонина-стандарта в тех же условиях равен 466,7.
) раствора фурадонина-стандарта в тех же условиях равен 466,7.
Решение: Согласно закону Бугера-Ламберта-Бера оптическая плотность испытуемого раствора (Ах) равна:
 , отсюда
, отсюда  – в фотометрируемом растворе, приготовленном в соответствии с методикой по схеме:
– в фотометрируемом растворе, приготовленном в соответствии с методикой по схеме:
g, % ® Р (100,0 г
¯
а  W1 (100,0 мл)
W1 (100,0 мл)
(0,0986 г) ¯
V ® W2 (100,0 мл) ®Ах; (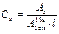 (%)).
(%)).
(0,6 мл)
Учитывая схему разведения, содержание фурадонина в анализируемом образце (g, %) равно:
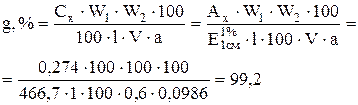
10. Рассчитайте содержание адреналина гидротартрата в растворе для инъекций (g, г/мл), если 5,0 мл препарата (а) довели водой до метки в мерной колбе вместимостью 100,0 мл (W1). Оптическая плотность 10,0 мл (V) полученного раствора, измеренная (после соответствующей обработки) на спектрофотометре при длине волны 520 нм в кювете с толщиной слоя 1,0 см составила 0,428 (Ах).Удельный показатель поглощения ( ) стандартного образца адреналина гидротартрата, определенный в тех же условиях, равен 47,5.
) стандартного образца адреналина гидротартрата, определенный в тех же условиях, равен 47,5.
Решение: Схема приготовления фотометрируемого раствора:
g, г ® Р (1,0 мл)
¯
а ® W1 ® V ® (А)
(5,0 мл) (100,0 мл) (10 мл)
Содержание адреналина гидротартрата (g, г) в растворе для инъекций составляет:
 .
.
11. Для количественного определения феназепама в таблетках по 0,001 г точную навеску порошка растертых таблеток массой 0,5345 г (а) поместили в мерную колбу вместимостью 50 мл (W1), добавили 30 мл 95% этанола, взболтали в течение 10 минут для растворения действующего вещества, довели объем раствора до метки, профильтровали. 2,5 мл (V) полученного раствора довели до метки 95% этанолом в мерной колбе вместимостью 25,0 мл (W2). Оптическая плотность указанного раствора, измеренная относительно этанола на спектрофотометре при длине волны 231 нм в кювете с толщиной слоя 1,0 см, составила 0,688 (Ах).
Оптическая плотность стандартного раствора, содержащего в 1 мл 0,000005 г (0,000005 г/мл) феназепама, измеренная в аналогичных условиях, равна 0,625 (Аст). Средняя масса одной таблетки 0,2138 г.
Решение: Содержание феназепама в фотометрируемом растворе (Сх) рассчитывают по формуле:

Содержание феназепама (g, г) в пересчете на среднюю массу одной таблетки (Р), учитывая схему приготовления фотометрируемого раствора, равно:
g, г ® Р (0,2138 г)
¯
а ® W1 (50,0 мл)
0,5345 (г) ¯
V ® W2 (25,0 мл) ® Ax (Cx)
2,5 (мл)
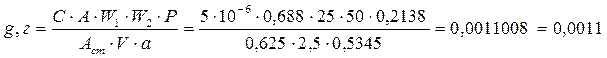 .
.
Дата добавления: 2015-07-25; просмотров: 3858 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Разложите карточки по методам анализа. | | | Билет 15 |