
Читайте также:
|
Тема 1. Основные понятия и законы химии. Классы неорганических соединений.
Химия изучает состав, строение, свойства и превращения веществ, а так же явления, которые их сопровождают. При химических превращениях или химических реакциях из одних веществ получаются другие.
Вещество состоит из отдельных частиц – молекул, атомов или ионов, которые являются объектами изучения химии.
Стехиометрия (от греч. stoicheion – элемент,основание) – учение о количественных соотношениях между реагирующими веществами и между атомами в формулах различных веществ.
Атом – (от греч. atomos – неделимый) – наименьшая химическая частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Молекула (от лат. moles- масса) – наименьшая частица вещества, определяющая его состав и свойства.
В зависимости от состава вещества делятся на простые и сложные. Простые вещества образованы атомами одного химического элемента. Например цинк, металл Zn, азот – газ - N2, сера, неметалл S, олово, металл Sn, кислород – газ – О2, хлор – газ – Cl2 и т.д. Сложные вещества образованы атомами разных элементов.
Наиболее важные классы неорганических соединений: оксиды, гидроксиды, кислоты, соли.
Оксидами – называются соединения элементов с кислородом. По своим химическим свойствам они подразделяются на солеобразующие и несолеобразующие. В свою очередь солеобразующие оксиды делятся на основные, кислотные, амфотерные.
Основными называются те оксиды, которые при взаимодействии с кислотами или кислотными оксидами образуют соли. Например: СаО, Na2O и т.п.
Кислотными называются оксиды, которые при взаимодействии с гидроксидами или основными оксидами образуют соли. Например: SO2, CO2 и т.п.
Амфотерными называются оксиды, которые образуют соли как при взаимодействии с основными, так и кислотными оксидами. Так Al2O3 растворяется с образованием солей в кислотах и щелочах.
Гидроксидами (основаниями) называются сложные вещества диссоциирующие в растворах или расплавах с образованием гидроксильных анионов. Так к гидроксидам относятся NaOH, Ca(OH)2 и т.п. В зависимости от содержания гидроксильных ионов основания делятся на однокислотные (NaOH), двухкислотные (Са(ОН)2) и т.д.
Кислотами называются сложные вещества, диссоциирующие в водных растворах или расплавах с образованием катионов водорода. Например: HCl, H3PO4 и т. п. По своему составу кислоты могут быть разделены на кислородсодержащие (HNO3, H2SO4) и бескислородные (HCl, HCN).В зависимости от числа содержащихся в молекуле кислоты атомов водорода, способных замещаться атомами металла, различают кислоты одноосновные (HNO3,HCl), двухосновные (H2CO3, H2SO4), трехосновные (H3PO4), четырехосновные (H4P2O7) и т.д.
Соли могут рассматриваться как продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или гидроксильных групп в молекуле основания кислотными остатками. При полном замещении атомов водорода или гидроксильных групп образуются средние (нормальные) соли, при неполном замещение атомов водорода образуются кислые соли (NaH2PO4; NaHCO3), при неполном замещении гидроксильных групп – основные соли ((CuOH)2CO3; Al(OH)2Cl). Кислые соли образуются многоосновными кислотами. Основные соли могут быть образованы только многокислотными основаниями.
Относительная молекулярная масса химического соединения (Мr) численно равна сумме относительных атомных масс (Аr) всех атомов, входящих в состав молекулы вещества.
Mr(H2O) = 2Ar(H) + Ar(O) = 2· 1 + 16 = 18
Моль – количество вещества (ν), содержащего столько же частиц (атомов, молекул или ионов), сколько атомов углерода содержится в 12г изотопа углерода 12С, т.е. 6,02·1023.
Молярная масса (М) – масса одного моля вещества. Численно совпадает с относительной молекулярной массой. Выражается в г/моль.
Мr(H2O) = 18, следовательно М (Н2О) = 18 г/моль
Пример 1. Осуществить цепочку превращения веществ и указать название каждого соединения.
Na → NaOH → NaHSO4 → Na2SO4 → BaSO4
1. 2Na + 2 H2O = 2 NaOH + H2
гидроксид натрия водород
2. NaOH + H2SO4 = NaHSO4 + H2O
серная кислота гидросульфат натрия вода
3. NaHSO4 + NaOH = Na2SO4 + H2O
сульфат натрия
4. Na2SO4 + BaCl2 = 2 NaCl + BaSO4↓
хлорид натрия сульфат бария
Основные стехиометрические законы химии
1. Закон сохранения массы веществ (1748 г. М.В.Ломоносов)
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
2. Закон постоянства состава (1808 г. Пруст)
Всякое чистое вещество, независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
3. Закон кратных отношений (1803 г. Д. Дальтон)
Если два элемента образуют между собой несколько соединений, то массовые количества одного элемента, соединяющиеся с одним и тем же массовым количествами другого элемента относятся между собой как небольшие целые числа.
4. Закон простых объёмных отношений (1808 г. Гей-Люссак)
Объёмы вступающих в реакцию газов при одинаковых условиях относятся друг к другу как стехиометрические коэффициенты (простые целые числа)
5. Закон Авогадро (1811 г. А.Авогадро)
В равных объёмах различных газов при одинаковых условиях (Р, Т) содержится одинаковое число молекул.
Следствие: Моль любого газа (при Р, Т = const) занимает один и тот же объём. 1 моль газа содержит 6,02 · 1023 молекул и занимает объём 22,4 дм3 при нормальных условиях (tо=0оС, То=273 К, Ро=101,3 кПа)
ν = 
 ν=
ν= 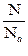
Пример 2. Вычислить массовую долю каждого элемента в молекуле карбоната кальция.
Решение: Формула соли – СаСО3, следовательно
М (СаСО3) = Аr(Са) + Аr(С) + 3·Аr(О) = 40 + 12 + 3· 16 = 100 г/моль
Массовую долю элемента в веществе рассчитываем по формуле:
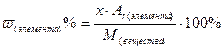
 ;
; 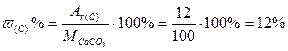
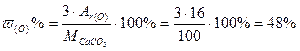
Пример 3. Какой объём углекислого газа образуется при сжигании 100 г угля содержащего 10% примесей.
Решение: Составляем уравнение химической реакции:
m(смеси) = 100г
ω(примесей) = 10% Vo-?
С + О2 = СО2
ν = 1моль ν = 1моль
М = 12 г/моль VM = 22,4 дм3
В 100 г смеси процентное содержание углерода равно 100% - 10% = 90%, что составляет в граммах 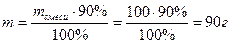 , отсюда
, отсюда  . По уравнению химической реакции
. По уравнению химической реакции 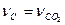 следовательно
следовательно 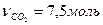 . Объём выделившегося газа будет равен
. Объём выделившегося газа будет равен 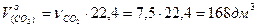
Контрольные задачи
В задании необходимо:
1. Написать уравнения реакций, которые необходимо провести для осуществления следующих превращений и указать название каждого соединения.
2. Рассчитать массовую долю элемента ω(х)% в подчеркнутом соединении.
3. Выполнить расчет по уравнению химической реакции в указанном варианте задания, отмеченной одной звездочкой.
Vо=5,6л m(соли)-? ω (Н)-?
1. N2 → NH3 *→ (NH4)2SO4 → NH 4 OH → NH4Cl → AgCl
m(смеси) = 3 кг
m(примеси) = 5% m(соли) -? ω (S)-?
2. Al → Al2O3 *→ AlCl3 → Al(OH)3 → Al 2 (SO 4 ) 3 → BaSO4
m (р-ра) = 20 г
ω (Са)-? С%(к-ты) = 10% m(соли) -?
3. Р → Р2О5 → Са 3 (РО 4 ) 2 *→ Н3РО4 → (NH4)3PO4 → AlPO4
m(смеси) =0,8 кг
ω(примеси) = 15% m(Fe) -? ω (О) -?
4. Fe(OH)3 → Fe2O3 * → Fe → FeSO4 → Fe(OH)2 → FeCl2
ω(примесей)=2%
Vо(газа)=1,12 дм3 m(соли) -? ω(Н)-?
5. Cl2 * → SiCl4 → Si → SiO2 → Na2SiO3 → H 2 SiO 3
Vо(газа)=4,48 дм3 m(соли) -? ω(Al)-?
6. СН4 → СО2 * → FeCO3 → FeO → Al2O3 → Na 3 [Al(OH) 6 ]
m(соли)-?
ω(примесей)=5% m(оксида)=15,3 г ω(Ва)-?
7. BaS *→ BaO → Ba → Ba(OH)2 → BaJ2 → Ba 3 (PO4) 2
Vр-р=100см3
ω(N)-? См=0,1 М Vо(газа)=?
8. HNO3 → NH 4 NO 3→ NH4OH * → NH3 → N2 → NO2
m(смеси)= 1кг
ω(примесей)=2% Vо(газа)-? ω(О)-?
9. MgO → Mg → MgCl2 → MgCO3 *→ CO2 → KHCO 3
m(смеси)=5кг
ω(примесей)=8% m(металла)-? ω(N)-?
10. NiO *→ Ni → NiSO4 → Ni(OH)2 → Ni(NO 3 ) 2 → NiCO3
Vо(газа)=4,48дм3 m(осадка)-? ω (Mn)-?
11. H2O2 → O2 → CO → CO2 *→ CaCO3 → Ca(MnO 4 ) 2
m(смеси)=?
ω(примесей)=10% m(соли)=15,8г ω(О)-?
12. Cr(OH)3 → Cr2O3 → Cr *→ CrCl3 → Cr(OH)3 → K 3 [Cr(OH) 6 ]
Vр-р=150см3
ω(K)-? См= 3М m(осадка)-?
13. K → K2S → K2O → KOH → K2 CrO4 * → BaCrO4
m(смеси)=20г
ω(примесей)-? Vо(газа)=11,2дм3 ω (Na)-?
14. S *→ SO2 → SO3 → Na 2 SO 4 → Na2S → H2S
m(смеси)=0,5кг
ω(примесей)=1,5% m(оксида)=? ω(Na)-?
15. Sn(OH)2 → SnSO4 → SnS → SnO → Sn → Na 2 [Sn(OH) 4 ]
Vр-р=100см3
См=0,2 М m(осадка)-? ω (К)-?
16. Pb → PbCl2 → Pb(NO3)2 *→ Pb(OH)2 → PbO → K 2 PbO 2
Vо газа=8,7 дм3
ω(примесей)=5% m (оксида)-? ω(O)-?
17. S → H2S *→ SO2 → H2SO 3 → Na2SO3 → CuSO3
m(смеси)=8кг
ω(примесей)=4% ω(оксида)-? ω(Cu)-?
18. CuS *→ CuO → Cu → Cu(NO3)2 → Cu(OH)2 → (CuOH) 2 SO 4
Vр-р-?
ω(H)-? См=0,1М m(осадка)=23,3г
19. Na2ZnO2 → Zn(OH) 2 → ZnO → Zn → ZnSO4 *→ BaSO4
m(смеси)=86г
ω(N)-? ω(примесей)=6% m(оксида)-?
20. Sr → Sr(OH)2 → Sr(NO 3 ) 2 → SrSO3 *→ SrO → SrPbO2
mр-ра=200г
m(оксида)-? С%= 5% ω(S)-?
21. Rb2O * → RbCl → Rb → RbOH → Rb 2 SO 4 → Rb2CO3
m(соли)=0,5кг Voгаза-? ω(N)-?
22. I2 → HI → NH4I *→ NH3 → NH 4 HCO 3 → MnCO3
m(смеси)=2кг
ω(O)-? ω(примесей)=15% m(соли)-?
23. Ni(OH) 2 → NiO *→ NiBr2 → NiS → H2S → NH4HS
mр-ра=150г
Voгаза-? С% = 6% ω(Ca)-?
24. F2 *→ KF → HF → H2O → Ca(OH) 2→ CaHPO4
m(смеси)=50г
Voгаза-? ω(примесей)=7% ω(С)-?
25. C → CO2 *→ Ca(HCO3)2 → CaCO 3 → CaO → Ca(OH)2
Дата добавления: 2015-07-25; просмотров: 105 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Изменение цвета осадка:___________________________________ | | | Тема 2. Эквиваленты |