
Читайте также:
|
Раствор – многокомпонентная однородная равновесная система, состоящая из растворителя и растворенных веществ. Растворы делятся на твердые (сплавы), жидкие, газообразные. Наиболее важным видом растворов являются жидкие растворы, характеристикой которых является их концентрация. Концентрация выражает содержание растворенного вещества в определенном количестве раствора или растворителя.
Существуют следующие способы выражения концентрации растворов: массовая, молярная, моляльная, нормальная, титр и т.д.
I. Массовая концентрация (процентная концентрация по массе) выражается отношением массы растворенного вещества к массе раствора:
 ; mраствора = mвещества + mрастворителя;
; mраствора = mвещества + mрастворителя;
т.к. mраствора = Vраствора · ρ, следовательно  .
.
II. Молярная концентрация определяется числом моль растворенного вещества в 1дм3 (1000 см 3) раствора:
 или
или 
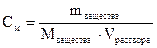 ;
;  [моль/ дм3]
[моль/ дм3]
III. Моляльная концентрация выражается числом моль растворенного вещества, содержащегося в 1 кг (1000 г) растворителя:
 или
или 
IV. Нормальная концентрация выражается числом моль-эквивалентов растворенного вещества, содержащегося 1дм3 раствора.
 или
или  ; [моль-экв/дм3]
; [моль-экв/дм3]
V. Титр определяется содержанием массы растворенного вещества в 1 см3 раствора:
 ; [г/мл]
; [г/мл]
При решении задач необходимо помнить закон эквивалентов (см. тему 2): объёмы реагирующих друг с другом растворов обратно пропорциональны их концентрации, выраженным в единицах нормальности.
Сн 1 V1 = Сн 1V1
Пример 1. Какой объем (см3) воды необходимо прибавить к 150 см3 30,0 % -ного раствора NaOH (ρ = 1,33 г/см3) для получения 12,0 %-ного раствора щелочи?
Решение: Масса исходного раствора равна mр-р = V . ρ = 150 . 1,33 = 199,5 г.
В этом 30,0% -ном растворе NaOH содержится  . По условию задачи эта масса NaOH
. По условию задачи эта масса NaOH  должна содержаться в 12,0 % растворе NaOH.
должна содержаться в 12,0 % растворе NaOH. 
Следовательно к исходному раствору необходимо прибавить 
т.к. ρ H2O=1 г/см3, отсюда V H2O=299 см3.
Пример 2. Определить молярную, нормальную концентрации и титр 20,0 %-ного раствора серной кислоты (ρ=1,14 г/см3)
Решение: Пусть объём раствора кислоты равен 1,00 дм3 (1000см3), тогда масса серной кислоты в нем 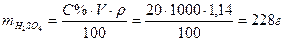 . Вычисляем молярную концентрацию раствора:
. Вычисляем молярную концентрацию раствора:
 [моль/ дм3], т.к. молярная масса эквивалента серной кислоты равна
[моль/ дм3], т.к. молярная масса эквивалента серной кислоты равна  г/моль-экв, следовательно нормальная концентрация раствора равна
г/моль-экв, следовательно нормальная концентрация раствора равна  моль-экв/дм3. Определяем титр раствора серной кислоты
моль-экв/дм3. Определяем титр раствора серной кислоты  г/мл.
г/мл.
Пример 3. Для нейтрализации 50 см3 раствора серной кислоты потребовалось добавить 23 см3 0,15Н раствора щелочи. Вычислите нормальную концентрацию раствора серной кислоты.
Решение: По закону эквивалентов вещества взаимодействуют в эквивалентных количествах: Сн(кислоты)·Vр-ра(кислоты)= Сн(щелочи)·Vр-ра(щелочи), следовательно 
Дата добавления: 2015-07-25; просмотров: 117 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Контрольные задачи | | | Контрольные задачи |