
Читайте также:
|
(с сульфосалициловой кислотой)
Железо(III) образует с сульфосалициловой кислотой в зависимости от кислотности раствора ряд окрашенных комплексов. При рН 1,8 - 2,5 образуется красно-фиолетовый катионный комплекс, имеющий полосу поглощения с lmax = 510 нм и emax = 1,8 . 103
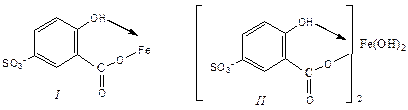
При увеличении рН до 4- 8 раствор приобретает красно-бурую окраску.
В щелочных средах (9 < рН < 11,5) образуется комплекс желтого цвета с полосой поглощения lmax = 416 нм и emax = 5,8 . 103.
Комплекс железа с сульфосалициловой кислотой в щелочной среде имеет следующий вид:
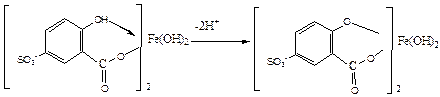
В результате упрочнения связи атома железа с фенольным кислородом происходит сдвиг полосы поглощения комплекса в коротковолновую область спектра. При рН > 12 происходит его разложение с выпадением в осадок гидроксида железа.
1. Кислая среда. В пять мерных колб вместимостью 50,0 мл вводят стандартные растворы железа объемом (мл): 1; 2; 3; 4 и 5 соответственно, 10 мл воды, 1 мл раствора серной кислоты, 5 мл раствора сульфосалициловой кислоты. Содержимое колб доводят водой до метки. Растворы фотометрируют относительно дистиллированной воды и строят градуировочный график.
Для определения железа в анализируемом растворе аликвоту этого раствора помещают в мерную колбу вместимостью 50,0 мл. С раствором проводят те же операции и в той же последовательности, что и при приготовлении растворов, используемых для градуировки, а затем фотометрируют относительно дистиллированной воды.
Содержание железа определяют по градуировочному графику, построенному по результатам фотометрирования растворов сравнения.
2. Щелочная среда. В пять мерных колб вместимостью 50,0 мл вводят стандартные растворы железа объемом (мл): 1; 2; 3; 4 и 5 соответственно, 10 мл воды, 5 мл раствора сульфосалициловой кислоты, 5 мл раствора аммиака. Содержимое колб доводят водой до метки. Растворы фотометрируют относительно дистиллированной воды и строят градуировочный график.
Для определения железа в анализируемом растворе аликвоту этого раствора помещают в мерную колбу вместимостью 50,0 мл. С раствором проводят те же операции и в той же последовательности, что и при приготовлении растворов, используемых для градуировки, а затем фотометрируют относительно дистиллированной воды. Содержание железа определяют по градуировочному графику.
Дата добавления: 2015-07-11; просмотров: 246 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ФОТОКОЛОРИМЕТРИЯ | | | ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА |