
|
Читайте также: |
Химически чистая вода является слабым электролитом, диссоциирующим в соответствии с уравнением
Н2О ⇄ Н+ + ОН–.
В водных растворах произведение [H+]∙[OH–] = KW, называемое ионным произведением воды, величина постоянная и при 20°С равна 10-14:
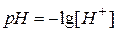 ,
, 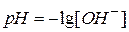 являются определениями рН и рОН, называются соответственно водородным и гидроксильным показателями), тогда
являются определениями рН и рОН, называются соответственно водородным и гидроксильным показателями), тогда
pH + pOH = 14.
При [H+] = [OH–] = 10–7 моль/л (рН = рОН = 7) среда нейтральная; при [H+] > [OH–] (рН < 7) – среда кислая; при [H+] < [OH–] (pH > 7) – среда щелочная.
Величина рН является одной из важнейших характеристик технологических растворов и природных систем, например, почвы. Значение рН влияет на многие процессы: растворимость удобрений в почве, усвояемость животными кормовых смесей, коррозию металлов и т.д.
Дата добавления: 2015-07-11; просмотров: 100 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Опыт 2. Определение карбонатной жесткости пробы воды | | | Диссоциация электролитов |