
|
Читайте также: |
Цель работы: определение жесткости природной воды объемным методом (методом титриметрии).
Теоретическая часть
Природная вода не является индивидуальным химическим соединением, описываемым формулой H2O. Это сложная система, содержащая взвешенные и коллоидные частицы, ионы и молекулы органических и неорганических веществ, различные микроорганизмы. В природной воде протекают физические, химические и биологические процессы: растворение и выделение газов, комплексообразование, выпадение и растворение осадков, жизнедеятельность микроорганизмов и т.д. Поэтому перед употреблением для технических и бытовых нужд вода, как правило, подвергается очистке от содержащихся в ней примесей.
Одной из характеристик природной воды является жесткость. Происхождение термина "жесткость" связано с тем, что при стирке в жесткой воде ткани становятся жесткими.
Жесткость воды обусловлена присутствием катионов Ca2+, Mg2+, а также катионов d и f-элементов (Fe2+, Fe3+, Zn2+, Mn2+, Cu2+ и др.). Содержание ионов d- и
f-элементов по сравнению с содержанием ионов Ca2+ и Mg2+ ниже, поэтому присутствием этих ионов иногда пренебрегают. Этим катионам в воде соответствуют анионы HCO3–, Cl–, SO42– и другие, существующие в свободном виде, поскольку неорганические соли являются сильными электролитами. Поэтому запись компонентов жесткости в молекулярной форме (Са(HCO3)2, MgCl2 и т.д.) является условной.
Повышенное содержание в природной воде ионов Ca2+ и Mg2+ объясняется частичным растворением в ней некоторых осадочных горных пород, таких как известняк CaCO3, доломит CaCO3  MgCO3, а также растворением некоторых компонентов почвы.
MgCO3, а также растворением некоторых компонентов почвы.
Различают жесткость временную (карбонатную) и постоянную (некарбонатную).
Временная ( карбонатная ) жесткость (Жв) обусловлена присутствием в природной воде ионов Ca2+, Mg2+, d- и f-элементов (Fe3+, Zn2+, Mn2+ и др.), которым в воде соответствуют анионы гидрокарбоната (HCO3–) (в молекулярной форме Са(HCO3)2, Mg(HCO3)2 и др.). Термин временная жесткость указывает на возможность устранения ее при кипячении.
Постоянная (некарбонатная) жесткость (Жп) обусловлена присутствием в природной воде ионов Ca2+, Mg2+, d– и f-элементов, солей кальция, магния, d- и f-элементов, которым в воде соответствуют анионы, не разлагающихся при кипячении (Cl–, SO42–, NO3–, Br– и др.), прежде всего хлоридов и сульфатов (в молекулярной форме CaCl2, MgCl2, CaSO4, MgSO4 и др.). Термин постоянная жесткостьуказывает на невозможность устранения ее кипячением.
Общей жесткостью воды (Жо) называется суммарная карбонатная и некарбонатная жеёсткость: Жо = Жв + Жп.
Величина жесткости в настоящее время в России характеризуется суммарным числом миллимоль-эквивалентов (ммоль-экв) определяющих ионов Ca2+, Mg2+, d- и f-элементов в 1 л воды и имеет размерность [ммоль-экв/л]. Один ммоль-экв жесткости отвечает содержанию 20,04 мг/л Ca2+, или 12,16 мг/л Mg2+.
Жесткость воды (ммоль-экв/л) можно рассчитать по формуле
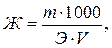
где m – масса растворенной соли, г; Э – молярная масса эквивалента этой соли, г/моль; V – объем пробы воды, л.
Согласно ГОСТ 2874–82, питьевая вода, подаваемая централизованными системами (??) хозяйственно-питьевого водоснабжения, должна иметь жесткость не > 7,0 ммоль-экв/л. Нет ли более близкого по дате ГОСТ,а??
Экспериментальная часть
Дата добавления: 2015-07-11; просмотров: 108 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Масса растворенного в 1 л вещества не зависит от способа выражения концентрации | | | Опыт 1. Определение общей жёсткости пробы воды |