
Читайте также:
|
В водных растворах кислоты, основания, соли диссоциируют на ионы.
Количественными характеристиками диссоциации электролита являются степень диссоциации и константа диссоциации.
Степень диссоциации (αд) определяется как отношение молярной концентрации продиссоциировавшего вещества (Сд) к общей концентрации вещества в растворе (Со). Степень диссоциации выражается в долях или в процентах:
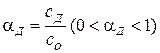 ;
; 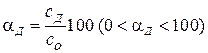 .
.
В расчетных выражениях степень диссоциации выражается, как правило, в долях.
Степень диссоциации возрастает с увеличением температуры и уменьшением концентрации электролита. Диссоциация протекает легче всего по первой ступени.
Для слабых электролитов важной количественной характеристикой, не зависящей от концентрации, является константа диссоциации.
Константой диссоциации (Кд) называется константа равновесия реакции диссоциации. Многие электролиты диссоциируют ступенчато, т.е. в несколько стадий. Различают константы диссоциации по I ступени (K1), II ступени (K2) и т.д. ступеням, а также константу полной диссоциации (K).
Для слабых электролитов при расчете Кд используют закон разбавления Оствальда:
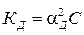 , где С – молярная концентрация электролита, моль/л; αД – степень диссоциации электролита, долей.
, где С – молярная концентрация электролита, моль/л; αД – степень диссоциации электролита, долей.
Дата добавления: 2015-07-11; просмотров: 102 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Диссоциация воды | | | Гидролиз солей |